2. 中国科学院 理化技术研究所 仿生材料与界面科学院重点实验室, 北京 100190;
3. 中国科学院大学, 北京 100049
2. CAS Key Laboratory of Bio-inspired Materials and Interfacial Science, Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Beijing 100190, P. R. China;
3. University of Chinese Academy of Sciences, Beijing 100049, P. R. China
无论是在体外构筑生物组织、促进受伤组织自修复,或是在体内用合成材料取代被破坏组织,还是进一步控制细胞的行为,都与细胞与人造材料之间的相互作用息息相关[1, 2]。在设计人工材料过程中,最常遇到的问题就是能否模拟一项或者多项细胞粘附和存活所必须的自然环境的特点。在自然界中,细胞的行为会被细胞环境所影响,因此作为与细胞相互作用的界面,其表面性质决定了细胞与材料相互作用的状态[3]。细胞的自然环境是非常复杂且动态的,这种特质导致研究细胞环境和仿生细胞环境的工作充满挑战。为了更好地理解细胞与材料间的相互作用并且进一步发展具有先进功能的生物材料,生物界面中的动态因素必须被考虑到[4]。基于细胞所处的多响应生物体环境的启示,可模拟生物环境来探索细胞行为的具有模拟多重复杂天然细胞环境的人造响应性界面吸引了越来越多的关注[5]。而刺激响应性界面则为成功制备具有动态与可逆性相结合特点的响应性生物界面提供了可能。
目前,包括响应pH值、热、磁、光、电、生物分子(如葡萄糖等)在内的智能材料正在不断进入构筑响应性细胞粘附界面的范畴。例如,利用具有热响应性的聚N-异丙基丙烯酰胺(PNiPAAm)分子修饰的纳米界面在高于PNiPAAm的低临界溶解温度(LCST)时呈疏水状态,在低于其LCST时,界面转变为亲水状态, 从而实现了温度调控导致的界面浸润性转变。在此基础上,引入可以通过疏水相互作用吸附于疏水界面的生物素修饰的胎牛血清白蛋白(biotin-BSA)作为锚点,即可将特异性识别癌细胞的抗体通过亲和素引入到界面上。在疏水状态下,biotin-BSA吸附于界面上,可以进行细胞的捕获;在亲水状态时,biotin-BSA从界面上脱落,细胞从界面上释放。因此, 通过设计热响应的浸润性转变界面可以实现可控的细胞捕获和释放[6]。
利用二茂铁与β-环糊精之间电化学敏感的超分子相互作用,可以构筑电化学响应的细胞捕获和释放界面。将能够与细胞特异性相互作用的DNA配体(aptamer)修饰到二茂铁分子上,以二茂铁与界面上修饰的β-环糊精之间的超分子相互作用为桥梁,可以将DNA配体成功引入到界面上以实现对细胞的特异性捕获。在电化学信号的刺激下,二茂铁发生性质转变,与β-环糊精之间的超分子相互作用随之消失,从而实现电化学刺激响应的细胞释放[7]。
此外,利用苯硼酸分子与癌细胞表面过量表达的唾液酸的相互作用,及其pH和葡萄糖分子响应的特性,可以构筑pH和葡萄糖分子双响应性界面。在弱酸性条件下,可以对癌细胞进行特异性捕获,而在中性条件和葡萄糖存在条件下,可以实现癌细胞的高效释放[8]。
包括热、电、pH、生物分子(DNA、葡萄糖等)在内的刺激源都会对细胞造成一定程度的条件侵入,而光刺激因为可以实现非入侵式并且实时控制的细胞粘附而日渐受到广泛关注。近年来,构筑光响应的细胞粘附界面的策略为操控细胞与界面以及细胞与细胞之间相互作用提供了一种有效的非侵入式手段。
2 光响应界面的分子响应机理光响应界面是通过化学或物理的手段将光响应功能分子引入到界面材料上,使界面在不同波长光的刺激下表现出不同物理化学性质的新型智能界面。这种智能界面的外界刺激操作便利,容易实现,已经被应用于包括界面浸润性调控[9]、抗菌性质调控[10]以及溶剂极性检测[11]等在内的诸多领域中。目前的光响应界面普遍采用的功能分子为偶氮苯和螺吡喃及其衍生物。这两种分子都能在不同波长光源的刺激下发生构型转变,进而改变智能界面的物理化学性质。
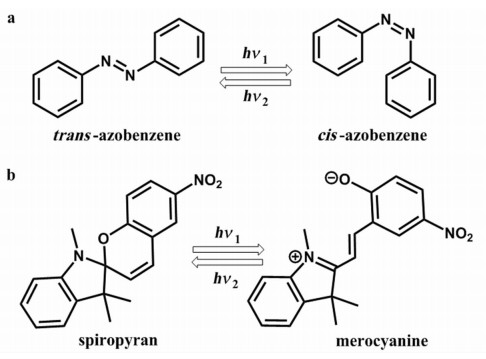
2.1 偶氮苯偶氮苯(azobenzene)具有反式(trans)和顺式(cis)两种构型,如图 1a所示,当355 nm的紫外光照射时,偶氮苯由反式构型向顺式构型转变;当450 nm及以上波长的光源照射时,偶氮苯则由顺式构型向反式构型转变。自从20世纪40年代发现顺式偶氮苯以后,偶氮苯的光响应性质以及构型转变机理引起了广泛的关注。从结构化学方面来看,偶氮苯分子的光致构型转变主要源于氮氮双键中π键的存在限制了两个氮原子的自由旋转,而由于双键和单键不在同一直线上,导致偶氮苯分子存在反式和顺式两种构型。偶氮苯从反式向顺式的光异构化伴随着明显的构型转变,使偶氮苯分子的偶极矩从反式构型的0 D转变为顺式构型的大约3 D,并呈现0.9 nm的尺寸变化。偶氮苯在光刺激下发生的顺反异构可以导致材料在物理化学性质方面(包括颜色、尺寸、形状、极性、折射率、溶解性等)发生变化。需要说明的是,偶氮苯的构型转变并不存在化学键的断裂,而是电子和原子核结构发生重排导致的。
|
图 1 a.偶氮苯的反式构型(trans)和顺式构型(cis):在特定光照条件下,偶氮苯可以发生可逆的光异构化构型转变;b.螺吡喃的两种异构体:左侧为闭环的螺吡喃构型(spiropyran),右侧为开环的部花青构型(merocyanine) Fig.1 a. Trans-and cis-isomers of azobenzene: under specific light irradiation, azobenzene can switch reversibly between two isomers; b. Isomers of spiropyran: the left isomer is ring-closed spiropyran and the right isomer is ring-open merocyanine |
作为另一种具有广泛应用的光响应分子螺吡喃, 其备受关注的原因是它的两种光异构体——螺吡喃(spiropyran,SP)和部花青(merocyanine,MC)具有非常明显的性质差异(图 1b)。在用可见光处理时,螺吡喃以SP异构体构型存在,这种闭环构型表现为较短的偶极矩(约4.3 D)以及疏水性质;而用紫外光照时,螺吡喃通过光异构化转变为MC构型,这是一种开环的两性离子构型,偶极矩约为17.7 D,并且呈亲水性质。特定波长的紫外光照引发的异构化反应以螺吡喃分子中的Cspiro—O键断裂为起始,使螺吡喃分子转变为cis-MC中间体,这种中间体可以通过紫外光照后的短暂吸收光谱探测。cis-MC中间体的C—C键旋转最终使其过渡到trans-MC。有趣的是,从SP到MC构型的光异构化转变可以通过近红外辐射实现,转变机理为双光子激发(紫外光刺激的光异构转变机理为单光子激发)。近红外刺激光异构转变对螺吡喃的实际应用具有重要意义,其一,近红外刺激会减少紫外光刺激导致的光降解,其二,近红外光在生物领域的应用较紫外光更具优势。螺吡喃分子发生化学键断裂时会导致包括浸润性、带电性、极性等物理化学性质的变化,这一特性为螺吡喃在不同领域中的广泛应用提供了条件。
3 光响应细胞粘附界面细胞与光响应界面之间的粘附行为取决于细胞外基质(extracellular matrix, ECM)与界面的相互作用。细胞外基质是由存在于细胞外的物质组成的网状材料,可以作为细胞的支架决定细胞的形状和活动[12]。整合素是位于细胞表面、决定细胞与微环境之间粘附作用的一类接受器(integrin)。因此, 为了增加基底与细胞之间的粘附作用,通常要在基底上修饰能与整合素相作用的分子。其中一类具有代表性应用的三肽RGD(arginine-glycine-aspartic)被广泛应用于促进整合素调控的细胞粘附。由于可以在RGD分子中天冬氨酸的羧基部位引入一些基团进行修饰[13],一些研究者将RGD与光响应分子偶氮苯等进行结合,实现了光响应细胞粘附界面的构筑。除RGD外,目前用于促进细胞粘附的分子还包括具有特异性识别的分子(如上皮细胞粘附分子抗体anti-EpCAM、苯硼酸等)和DNA配体等。光响应细胞粘附界面往往也需要这些分子以实现细胞的高效粘附,而在光源刺激下发生的界面性质转变是光响应细胞粘附界面功能得以实现的根本原因。
3.1 偶氮苯类光响应细胞粘附界面反式偶氮苯与β-环糊精之间存在主客体超分子相互作用,而顺式偶氮苯与β-环糊精之间不存在超分子相互作用,这种光响应相互作用的转变,提供了一种构筑光响应细胞粘附界面的方法。首先将硅基底用3-缩水甘油醚氧基丙基三甲氧基硅烷[(3-glycidyloxypropyl)trimethoxysilane]修饰,修饰后的基底可以通过浸泡的方法,将带有氨基的β-环糊精(NH2-β-环糊精)修饰在硅基底上。通过反式偶氮苯与β-环糊精的主客体超分子相互作用,就可以使偶氮苯连接于基底上[14]。细胞粘附因子(例如RGD)可以通过化学合成的方法修饰于偶氮苯分子上,从而提高细胞粘附效率。偶氮苯分子在光致构型转变过程中,其与环糊精之间的主客体超分子相互作用可以决定细胞与基底之间的粘附行为。光控条件下的偶氮苯分子与环糊精之间的超分子相互作用存在/消失引起细胞粘附因子吸附于界面上或者从界面上脱附,进而实现对细胞粘附和去粘附的调控。
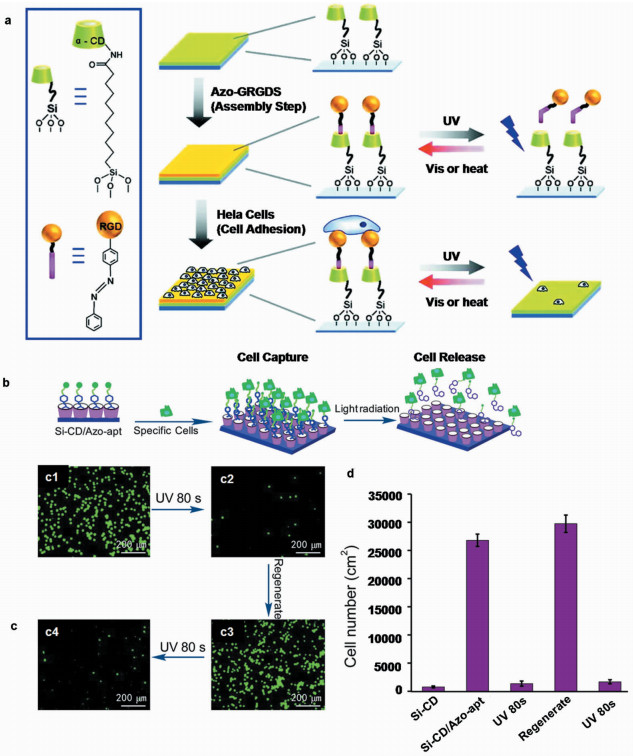
利用偶氮苯分子与环糊精之间的主客体超分子相互作用,可构筑修饰有细胞粘附因子RGD的光响应细胞粘附界面,如图 2所示[14]。在可见光条件下,反式偶氮苯与环糊精之间通过主客体超分子相互作用,使细胞粘附因子成功修饰到界面上,从而实现细胞的高效粘附。当用紫外光处理细胞粘附界面时,由于偶氮苯从反式构型转变为顺式构型,其与环糊精之间的相互作用消失,表面修饰的细胞粘附因子随细胞从基底脱离。这种通过控制偶氮苯与环糊精之间的超分子相互作用的策略来调节细胞的粘附和去粘附行为具有简单的可操作性,但是由于在细胞去粘附过程中,修饰有细胞粘附因子的偶氮苯一同脱落,因此基底不能实现可逆的细胞粘附和去粘附。利用主客体超分子相互作用控制细胞粘附的另一种方式,是将偶氮苯修饰于基底上,通过喂养细胞的方式,将环糊精引入细胞表面。这种方法因为给细胞引入环糊精,使操作难度增大,但却为研究细胞与基底之间的相互作用提供了一种新的思路。首先用Ac4GalNAz分子喂养细胞,使细胞表面富集具有叠氮化物位点的糖多聚物,而后叠氮化位点可以与具有炔基集团的PEG-β-CD(alkynyl-PEG-β-CD)在一价铜离子的催化作用下发生共轭反应,从而将β-CD修饰到细胞膜表面。将偶氮苯按照一定的图案修饰到基底上以后,通过反式偶氮苯与环糊精之间的主客体超分子相互作用,在修饰有偶氮苯的区域会粘附细胞,非修饰区域则不会粘附细胞。紫外光处理后引发反式偶氮苯转变为顺式偶氮苯的异构化,导致了细胞从基底上脱落。作为对比,没有紫外光处理的基底,只有14%的细胞去粘附,而紫外光照处理的基底,大约84%细胞从基底脱落。这种设计使偶氮苯基底可以控制细胞在2D基底上实现时间空间可控的粘附与去粘附并且可以重复使用,能进一步应用到组织工程领域,但缺点是对细胞进行环糊精修饰使实验更加复杂。
|
图 2 Gong等[14](a)和Bian等[18](b~d)利用偶氮苯与环糊精之间的超分子相互作用,实现光响应细胞粘附界面对细胞的捕获与释放 a.将细胞粘附因子RGD修饰于偶氮苯分子上,使光响应界面具有高效的细胞捕获效率,在光照刺激下,顺式偶氮苯与环糊精之间的超分子相互作用消失,细胞从光响应界面上释放;b.具有拓扑结构的界面在偶氮苯修饰后细胞捕获和释放的示意图;c~d.具有拓扑结构的光响应界面对细胞的可逆捕获和释放荧光照片以及细胞粘附数目统计。相较于平面,拓扑结构可以增加细胞的捕获和释放效率,释放细胞后的界面通过再次修饰,可以实现可逆的细胞捕获 Fig.2 Gong et al.[14] (a) and Bian et al.[18] (b-d) realized photo-responsive cell capture and release using the supermolecular interaction between azobenzene and cyclodextrin a. Photo-responsive surfaces with azobenzene modified by RGD can capture cells with high efficiencies. After irradiation, the cells can be released from surfaces because the vanishment of supermolecular interaction between azobenzene and cyclodextrin; b. Scheme of topographic surface modified by azobenzene for cell capture and release; c-d. Fluorescent images of reversible cell capture and release and the quantification of cells on the surfaces. Compared to flat surfaces, the topography can enhance the efficiencies of cell capture and release. After cell release, the surfaces can be remodified for cell capture |
以上的工作都把关注点集中在光响应界面分子层次上的设计,而忽略了界面材料本身拓扑结构对细胞的影响[15-17]。2016年,Bian等[18]利用光响应分子与界面拓扑结构的协同效应,构筑了一种高效的应用于癌细胞捕获和释放的光响应界面,极大提高了细胞捕获和释放效率。这种界面利用偶氮苯与环糊精之间的主客体超分子相互作用,将修饰有配体(Aptamer,一段DNA链段,可以特异性识别乳腺癌细胞MCF-7)的偶氮苯通过环糊精固定在硅基底上,如图 2b中所示。图 2c中细胞捕获和释放的荧光照片说明基底具有捕获和释放细胞的能力,并且通过对基底的再次修饰,可以实现细胞的可逆捕获/释放,并保持高效。利用拓扑相互作用与Aptamer对细胞的特异性识别两者的协同作用,光响应基底可以实现高效的细胞捕获/释放,细胞的捕获数目高达26800±1090 cm-2,而紫外光照导致的偶氮苯异构化使得捕获的细胞从基底上被释放出来,释放后的残留细胞数目低至1363±454 cm-2,如图 2d中所示。可见,拓扑结构的引入极大地提高了光响应界面对细胞的捕获和释放效率。这种具有特异性细胞识别能力的光响应界面,可以从多种细胞中选择性地捕获某一种细胞,为光响应界面在细胞特异性捕获释放领域的应用提供了一种高效的方法。
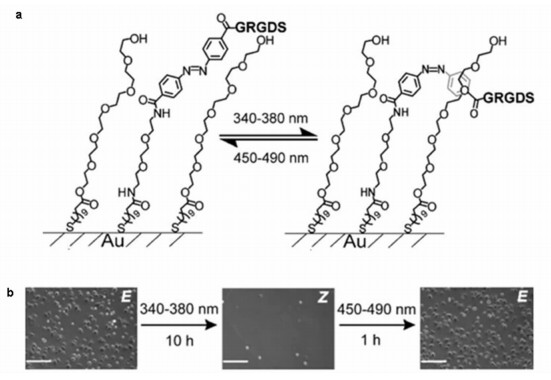
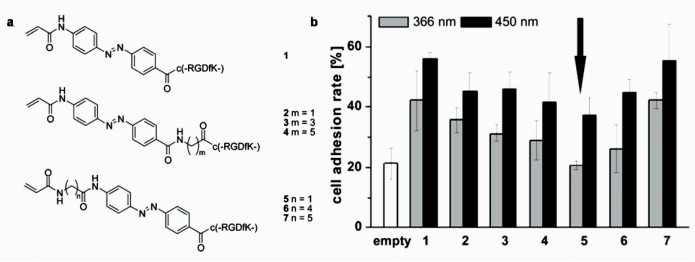
利用偶氮苯分子与环糊精之间的主客体超分子相互作用往往得到不可重复使用的光响应界面,因为在细胞去粘附过程中,修饰有细胞粘附因子的偶氮苯分子或者环糊精分子会随细胞脱离界面。相反地,偶氮苯的顺式反式构型转变,可以直接引起修饰于末端的细胞粘附分子发生取向变化,从而实现可逆的细胞粘附/去粘附的开关作用。Liu等[19]将修饰有细胞粘附因子RGD的偶氮苯分子通过巯基与金之间的化学键合吸附到基底上,制备成具有光响应的细胞粘附界面。当偶氮苯呈反式构型时,末端的细胞粘附因子暴露为可接触细胞的状态,能够有效粘附细胞。当偶氮苯在光源刺激下转变为顺式构型时,偶氮苯分子取向发生的异构化导致细胞粘附因子隐藏于分子链之间,因此细胞粘附因子与细胞的相互作用消失,细胞去粘附。再次用光源刺激使偶氮苯恢复反式构型时,细胞粘附因子重新暴露于界面表面,又可以实现基底对细胞的粘附,如图 3所示。这种方法由于不需要对基底进行再次修饰即可以重复使用,因此相较于主客体超分子相互作用的释放机制,具有一定优势。然而,这种设计思路必须考虑到,某些影响因素(包括连接细胞粘附因子的偶氮苯分子链长和修饰的分子密度等)会对光响应细胞粘附界面的响应行为产生影响。通过设计具有不同链长的偶氮苯分子并修饰于基底上,考察不同链长界面对细胞的粘附和光响应去粘附行为,可以为链长参数的选取提供参考。如图 4所示,Auernheimer等[20]以一定长度的分子链段作为调节链长的间隔链段,并将这种链段安插到偶氮苯基团与细胞粘附因子之间或者偶氮苯与基底之间,来观察可能出现的取向问题。当分子链较短时,顺式(链长1.25 nm)到反式(链长0.69 nm)构型的光致异构化并不能使细胞有效去粘附,可能原因是分子链较短时,细胞粘附因子不能有效隐藏于分子链中,导致细胞去粘附效率低。增加分子链长度可以一定程度提高细胞去粘附效率,但由于链长可能导致分子倒塌而使细胞粘附因子不能充分接触细胞,因此细胞粘附效率也会下降。间隔分子链段所处位置对分子链长度的转变同样重要。对比2号分子和5号分子发现,间隔分子处于偶氮苯基团与基底之间的位置时,基底的细胞脱附效率更高[20]。此外,分子堆积的紧密程度对偶氮苯光致异构化效率也具有显著的影响[21]。
|
图 3 Liu等[19]设计的可逆光响应细胞捕获和释放界面,偶氮苯分子通过巯基与金相互作用形成光响应自组装单层用于可逆的细胞粘附和脱附 a.偶氮苯分子在光源刺激下构型发生顺式和反式之间的可逆变化,导致细胞粘附因子RGD隐藏或者暴露在界面上,从而控制细胞粘附和脱附;b.细胞在界面上的可逆粘附和脱附 Fig.3 Liu et al.[19] designed reversible photo-responsive surfaces containing azobenzene for cell capture and release by the interaction between Au and S a. Under photo stimuli, azobenzene switch reversibly between trans-and cis-isomers to control the direction of RGD which further induced cell adhesion and detachment; b. Reversible cell adhesion and detachment on the photo-responsive surfaces |
|
图 4 Auernheimer等[20]设计了不同链长的含偶氮苯基团分子修饰界面,探究分子链长对偶氮苯基团响应性的影响 a.具有不同链长以及间隔片段在不同位置的含偶氮苯基团分子式;b.不同链长分子修饰的光响应基底对细胞粘附/脱附效率 Fig.4 Auernheimer et al.[20] investigated the effect of molecular length on the responsiveness of azobenzene by designing a set of azobenzene molecules with different molecular length a. Set of cyclic RGD peptides containing a photoswitchable 4-[(4-aminophenyl)azo]benzocarbonyl unit; b. Efficiencies of cell adhesion and detachment on photo-responsive surfaces modified by a set of molecules |
如图 5所示,Bian等[21]利用化学吸附法和静电层层自组装技术制备了具有偶氮苯分子的不同紧密堆积度的光响应细胞粘附界面,通过对比细胞粘附特性以及界面浸润性的变化,说明分子更紧密堆积的化学吸附界面在光刺激下浸润性转变效率更低,说明偶氮苯的光异构化效率由于分子间紧密堆积造成的空间位阻而降低了。综上所述,偶氮苯分子异构化导致的细胞粘附/去粘附虽然需要调节分子链段长度和堆积程度等参数,但由于减少了环糊精修饰步骤,使实验方法更为简单,并且可以重复用于细胞粘附/去粘附。
|
图 5 Bian等[21]以化学吸附法以及静电LbL自组装法制备了具有不同分子紧密堆积度的光响应细胞捕获界面,以探究分子堆积程度对光响应界面的影响 a.化学吸附法制备的光响应界面,偶氮苯分子堆积更为紧密,导致构型转变效率低,细胞脱附效果差,接触角变化小;b.静电LbL自组装法制备的光响应界面,偶氮苯分子堆积较为松散,光响应构型转变效率高,可以实现较高的细胞粘附和去粘附效率,接触角的变化增大 Fig.5 Bian et al.[21] investigated the effect of molecular packing density on the responsiveness of azobenzene modified surfaces by chemisorption and electrostatic layer-by-layer (LbL) assembly techniques a. Photo-responsive surfaces which were fabricated by chemisorptions with denser packing resulted in low efficiencies of isomerization, cell detachment, and change of water contact angle; b. Photo-responsive surfaces which were fabricated by electrostatic LbL assembly with looser packing resulted in high efficiencies of isomerization, cell adhesion and detachment, and change of water contact angle |
此外,偶氮苯类水凝胶作为一种光响应细胞粘附界面,可以高度模拟细胞外基质,而且合成水凝胶的分子也多种多样,为材料设计提供了多种选择。通过调节水凝胶合成过程中交联剂的含量,可以有效控制水凝胶的机械性能,进而调节细胞粘附行为。光响应水凝胶往往通过在一些水凝胶中(如聚丙烯酸等)依靠化学键合或者氢键等作用添加具有光响应性的分子[22, 23]并施加光刺激,使偶氮苯类水凝胶发生凝胶-溶胶转变,从而引发细胞粘附/去粘附。
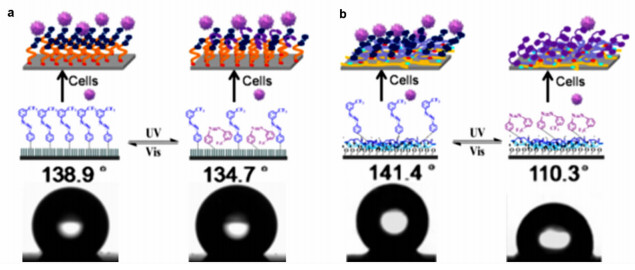
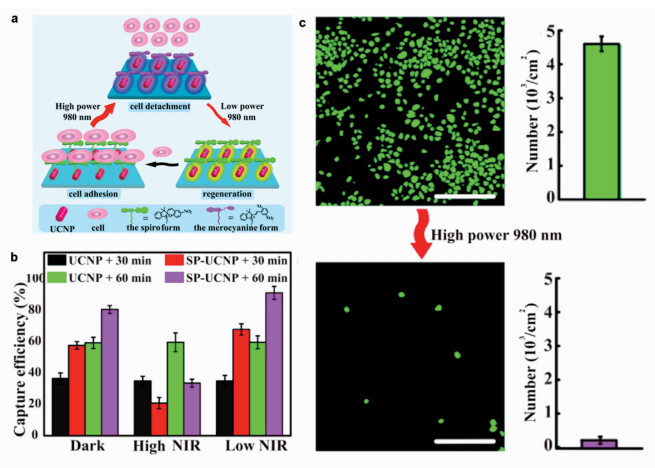
3.2 螺吡喃类光响应细胞粘附界面螺吡喃分子与细胞之间具有某种特别的相互作用,可以用来控制细胞在界面上的粘附与去粘附状态[24]。2015年,Li等[25]将螺吡喃分子修饰到上转换纳米颗粒上,制备了一种可以用近红外光控制的细胞粘附/去粘附界面。闭环状态的螺吡喃分子与细胞表面的纤连蛋白具有特异性的相互作用,当光照使螺吡喃分子处于闭环构型时,光响应界面具有粘附细胞的性质。当红外光经过上转换纳米颗粒激发螺吡喃分子由闭环构型转变为开环构型时,闭环螺吡喃与细胞表面的纤连蛋白之间的相互作用消失,导致细胞去粘附,如图 6所示。可见,螺吡喃构筑的细胞粘附界面不需要额外修饰RGD、配体、抗体等即可实现与细胞的相互作用。在经过10次细胞粘附-去粘附循环后,光响应界面仍然能够保持有效的细胞粘附和去粘附行为。近红外光的应用,不仅减少了紫外光对细胞的伤害,相较于紫外光,其对组织的穿透力也更强一些:实验中,即使需要穿透6 mm的猪皮来刺激细胞去粘附, 近红外光响应界面仍保持着明显的优势,为细胞粘附界面在体内的应用提供了可能。但是这种闭环螺吡喃与细胞之间的相互作用并未进一步得到证实。此前,Edahiro等[26]将光响应的螺吡喃分子与热响应的N-异丙基丙烯酰胺(NiPAAm)用共聚的方法合成具有光响应性的共聚物,并将其涂到玻璃基底上制备了光热双响应的界面。这种界面可以用于增强细胞(仓鼠卵巢细胞CHO-K1)与基底之间的粘附作用,如图 7所示。当细胞在光热响应界面上培养一段时间以后,对某特定区域进行紫外光照处理以及整体的降低温度处理,结果显示,紫外光照的区域细胞仍然粘附在基底上,而未经光照的部分,细胞基本从界面上去粘附。如果继续对该区域进行可见光照处理,使螺吡喃重新异构化为闭环构型,再降低温度则细胞从界面上去粘附。因此,研究人员认为紫外光照后的开环螺吡喃(MC)的两性离子性质可能对细胞具有某种粘附作用。以上两种螺吡喃构筑的光响应界面对细胞粘附的相反作用说明单纯依靠螺吡喃分子与细胞的粘附作用是难以设计普适的光响应细胞界面的,这可能是实验中采用的细胞种类不同导致的。这种现象也提示我们,由于细胞具有复杂性,可能无法得到某种具有普适性的粘附/去粘附行为控制的光响应界面,这使得研究制备光响应细胞粘附界面仍面临着很大挑战。
|
图 6 Li等[25]制备的螺吡喃分子修饰的基于上转换纳米颗粒的光响应细胞粘附与去粘附界面 a.光响应界面在光源刺激下对细胞的粘附和脱附行为示意图;b.螺吡喃修饰的界面SP-UCNP和对照试验在不同光照刺激下细胞的捕获效率,SP-UCNP界面在较低功率红外光的刺激60 min的状态下,细胞捕获效率最高; c.修饰有螺吡喃的界面在高功率红外光刺激下细胞释放的荧光照片以及捕获/释放后细胞数目 Fig.6 Li et al.[25] designed photo-responsive surfaces for cell adhesion and detachment using spiropyran modified upconversion particles (UCNP) a. Scheme of cell adhesion and detachment of photo-responsive surfaces under stimuli; b. Efficiencies of cell adhesion of SP-UCNP and control surfaces under different stimuli, the highest efficiency of cell adhesion was achieved by treating low NIR for 60 min; c. Fluorescent images and quantification of cell adhesion and detachment under high NIR irradiation |

|
图 7 Edahiro等[26]证明螺吡喃修饰的光响应界面在紫外光照条件下对细胞具有粘附增强效果。 a-f.细胞实验过程示意图;g.对应示意图a的显微镜照片,细胞粘附与界面上,黄框部分为紫外光照区域;h.对应示意图b的显微镜照片,紫外光照区域的细胞不易去粘附;i.对应图f的荧光照片,证明紫外光照后部花青(MC)对细胞粘附的增强作用 Fig.7 Edahiro et al.[26] demonstrated enhanced cell adhesion on spiropyran modified surfaces under UV light a-f. Scheme of experiment procedures for cell adhesion control; g. Microscope image corresponding to a with cell adhesion; h. Microscope image corresponding to b showed enhanced cell adhesion in the yellow square which was treated by UV light; i. Fluorescent image corresponding to f illustrated the enhancement of MC for cell adhesion |
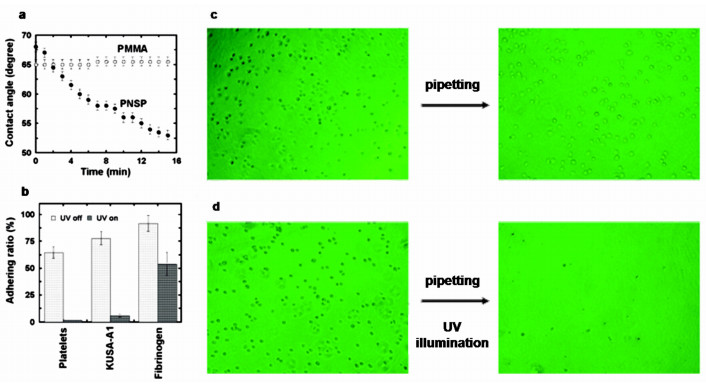
从更加普适的性质转变角度来设计,螺吡喃修饰的光响应细胞粘附界面,因螺吡喃分子异构化转变前后发生的包括浸润性、极性、电荷性质的变化,具有更为宏观且确定的物理化学性质转变,其中界面浸润性的改变可以通过疏水相互作用调节细胞的粘附和去粘附。2004年,Higuchi等[27]将聚甲基丙烯酸甲酯和螺吡喃的共聚物poly(NSP-co-MMA)涂到玻璃基底上,利用螺吡喃在紫外光照处理后浸润性和极性的变化来控制血小板、间叶干细胞(KUSA-A1)以及纤连蛋白原的粘附与去粘附。在紫外光照后,闭环的非极性疏水螺吡喃(SP)转变为开环的两性离子亲水螺吡喃(MC),界面由疏水状态转变为亲水状态,血小板以及间叶干细胞更倾向于粘附在疏水界面,因而细胞从亲水界面上脱附,如图 8中所示。通过利用螺吡喃的物理化学性质在异构化前后的明显转变,可以直接有效地控制细胞的粘附和去粘附。相较于偶氮苯构筑的光响应界面,螺吡喃存在的一大优势就是不需要进行配体或者RGD等的修饰,并且可以重复使用,而不用在每次细胞去粘附后再对界面重新修饰。在螺吡喃构筑的光响应水凝胶体系中,也发现当螺吡喃处于闭环构型时,细胞高效地粘附于水凝胶表面,而紫外光照触发螺吡喃转变为开环构型时,由于界面变得更为亲水,导致细胞从水凝胶基底上去粘附。
|
图 8 Higuchi等[27]制备的螺吡喃修饰光响应细胞粘附界面浸润性改变导致的细胞粘附与去粘附 a.螺吡喃修饰的界面与对照界面不同光照时间的水接触角变化,随着时间增加,螺吡喃光响应界面变得更加亲水;b.血小板、间叶干细胞以及纤连蛋白原在光响应界面上的粘附和脱附:血小板和间叶干细胞的脱附效率较高,而纤连蛋白原在界面上难以脱附;c.细胞粘附后不施加光刺激,细胞难以从界面上脱附;d.紫外光照后,光响应界面变得更加亲水,细胞脱附 Fig.8 Higuchi et al.[27] designed photo-responsive surfaces modified by SP for cell adhesion and detachment via switch of wettability a. Change of water contact angle under irradiation for different time, SP modified surfaces became more hydrophilic as prolonged irradiation time; b. Adhesion and detachment of platelets, KUSA-A1 cells and fibrinogen, the detachment efficiencies of platelets and KUSA-A1 cells are higher than fibrinogen; c. KUSA-A1 cells cannot detach from the surfaces without photo; d. Photo-induced KUSA-A1 cell detachment from the surfaces |
近年来, 光响应细胞粘附界面吸引了越来越多的研究目光,并得到了长足的发展,但是要达到高效的细胞粘附和去粘附,仍面临着比较大挑战。
4.1 用于增强细胞粘附的生物分子目前应用比较广泛的可以提高细胞与基底的粘附作用的生物分子, 包括RGD、一些具有特异性识别能力的配体或抗体,以及对某些在细胞表面过量表达物质具特异性的分子(如能与癌细胞表面过表达的唾液酸相互作用的苯硼酸)。但是配体和抗体的筛选是复杂而困难的,而类似苯硼酸的分子目前报道很少。2013年,有报道[6]通过疏水相互作用将抗体引入响应性界面并用于细胞的捕获和释放:通过外界刺激引发响应性界面发生浸润性由疏水到亲水的变化,从而将捕获的细胞从界面上释放。这一方法提供了一种较为普适的调控手段,不依靠特定分子,而通过改变界面的物理化学性质调控细胞的粘附行为。
4.2 光响应分子构型转变过程中的位阻问题偶氮苯和螺吡喃分子在光致异构化过程中均存在空间位阻的影响,这种影响使得分子的光转变效率变低,尤其当分子以聚合物的形式修饰到表面时,由于空间上的紧密排列,使得分子要发生构型转变愈加困难[28]。目前为了降低光响应分子间的空间位阻效应,有报道[29]加入共聚的分子以增大光响应分子之间的距离,从而有效减少光异构化过程中的空间位阻效应,提高响应效率。
4.3 细胞粘附界面与自然环境的差异虽然一些模拟细胞生存环境的响应性界面已经被成功制备,但是这些界面均存在效率低、响应时间长、响应性单一等问题。要制备能够比拟细胞天然复杂环境并有望应用于生物医药领域的响应界面仍然任重道远。此外,作为生物组成的最小基本单元,细胞也是种类繁多的,不同种类的细胞其特性不同,需要的粘附界面性质也不同,加大了研究难度。一些应用于生物医药领域的细胞粘附界面,不仅要具备粘附细胞的能力,也要具备排除其他细胞(如血液中的红细胞、血小板等)粘附的能力,否则背景噪音会为后续细胞的分析带来困难。
即使存在上述的种种困难和挑战,光响应细胞粘附界面在生物医药方面的应用中仍占重要地位。利用光响应分子可以制备二维光响应界面以及三维光响应凝胶, 用于细胞的可控粘附和去粘附,调控细胞分化行为,以及细胞检测和诊疗。作为一种非入侵式刺激,光刺激可以通过调节光波长、光强度和光照时间来进一步设计程序化且时空可控的细胞粘附界面。基于以上优势,光响应粘附界面在生物医药领域会引起越来越多的关注和更深入的研究。
致谢 感谢国家自然科学基金项目(21425314;21434009;21404109;21421061)、北京市科学技术委员会(Z161100000116037)、科学技术部(2013YQ190467)、国家青年拔尖人才项目以及中国科学院青年创新促进会(2016026)的资助!| [1] | Green J J, Elisseeff J H. Mimicking biological functionality with polymers for biomedical applications[J]. Nature, 2016, 540: 386–394. DOI:10.1038/nature21005 |
| [2] | Lutolf M P, Gilbert P M, Blau H M. Designing materials to direct stem-cell fate[J]. Nature, 2009, 462: 433–441. DOI:10.1038/nature08602 |
| [3] | Sachs N, Sonnenberg A. Cell-matrix adhesion of podocytes in physiology and disease[J]. Nature Reviews Nephrology, 2013, 9: 200–210. DOI:10.1038/nrneph.2012.291 |
| [4] | Obokata H, Wakayama T, Sasai Y, Kojima K, Vacanti M P, Niwa H, Yamato M, Vacanti C A. Stimulus-triggered fate conversion of somatic cells into pluripotency[J]. Nature, 2014, 505: 641–647. DOI:10.1038/nature12968 |
| [5] | Dhowre H S, Rajput S, Russell N A, Zelzer M. Responsive cell-material interfaces[J]. Nanomedicine, 2015, 10: 849–871. DOI:10.2217/nnm.14.222 |
| [6] | Liu H L, Liu X L, Meng J X, Zhang P C, Yang G, Su B, Sun K, Chen L, Han D, Wang S T, Jiang L. Hydrophobic interaction-mediated capture and release of cancer cells on thermoresponsive nanostructured surfaces[J]. Advanced Materials, 2013, 25: 922–927. DOI:10.1002/adma.v25.6 |
| [7] | Feng L Y, Li W, Ren J S, Qu X G. Electrochemically and DNA-triggered cell release from ferrocene/beta-cyclodextrin and aptamer modified dual-functionalized graphene substrate[J]. Nano Research, 2015, 8: 887–899. DOI:10.1007/s12274-014-0570-4 |
| [8] | Liu H L, Li Y Y, Sun K, Fan J B, Zhang P C, Meng J X, Wang S T, Jiang L. Dual-responsive surfaces modified with phenylboronic acid-containing polymer brush to reversibly capture and release cancer cells[J]. Journal of the American Chemical Society, 2013, 135: 7603–7609. DOI:10.1021/ja401000m |
| [9] | Wang D, Jiao P W, Wang J M, Zhang Q L, Feng L, Yang Z Z. Fast photo-switched wettability and color of surfaces coated with polymer brushes containing spiropyran[J]. Journal of Applied Polymer Science, 2012, 125: 870–875. DOI:10.1002/app.v125.2 |
| [10] | Deng J, Liu X Y, Shi W B, Cheng C, He C, Zhao C S. Light-triggered switching of reversible and alterable biofunctionality via β-cyclodextrin/azobenzene-based host-guest interaction[J]. ACS Macro Letters, 2014, 3: 1130–1133. DOI:10.1021/mz500568k |
| [11] | Florea L, Mckeon A, Diamond D, Benito-Lopez F. Spiropyran polymeric microcapillary coatings for photodetection of solvent polarity[J]. Langmuir, 2013, 29: 2790–2797. DOI:10.1021/la304985p |
| [12] | Karp G, Patton J G. Cell and Molecular Biology[M]. New York: John Wiley & Sons, 2013: 231-254. |
| [13] | Petersen S, Alonso J M, Specht A, Duodu P, Goeldner M, del Campo A. Phototriggering of cell adhesion by caged cyclic RGD peptides[J]. Angewandte Chemie International Edition, 2008, 47: 3192–3195. DOI:10.1002/(ISSN)1521-3773 |
| [14] | Gong Y H, Li C, Yang J, Wang H Y, Zhuo R X, Zhang X Z. Photoresponsive "smart template" via host-guest interaction for reversible cell adhesion[J]. Macromolecules, 2011, 44: 7499–7502. DOI:10.1021/ma201676w |
| [15] | Wang S T, Wang H, Jiao J, Chen K J, Owens G E, Kamei K I, Sun J, Sherman D J, Behrenbruch C P, Wu H, Tseng H R. Three-dimensional nanostructured substrates toward efficient capture of circulating tumor cells[J]. Angewandte Chemie International Edition, 2009, 48: 8970–8973. DOI:10.1002/anie.v48:47 |
| [16] | Zhang P C, Chen L, Xu T L, Liu H L, Liu X L, Meng J X, Yang G, Jiang L, Wang S T. Programmable fractal nanostructured interfaces for specific recognition and electrochemical release of cancer cells[J]. Advanced Mate-rials, 2013, 25: 3566–3570. DOI:10.1002/adma.201300888 |
| [17] | Kocer G, ter Schiphorst J, Matthew H, Kassa H G, Leclere P, Schenning A P H J, Jonkheijm P. Light-responsive hierarchically structured liquid crystal polymer networks for harnessing cell adhesion and migration[J]. Advanced Materials, 2017, 29: 1606407–1606414. DOI:10.1002/adma.v29.27 |
| [18] | Bian Q, Wang W S, Wang S T, Wang G J. Light-triggered specific cancer cell release from cyclodextrin/azobenzene and aptamer-modified substrate[J]. ACS Applied Mate-rials & Interfaces, 2016, 8: 27360–27367. |
| [19] | Liu D B, Xie Y Y, Shao H W, Jiang X Y. Using azobenzene-embedded self-assembled monolayers to photochemically control cell adhesion reversibly[J]. Angewandte Chemie International Edition, 2009, 48: 4406–4408. DOI:10.1002/(ISSN)1521-3773 |
| [20] | Auernheimer J, Dahmen C, Hersel U, Bausch A, Kessler H. Photoswitched cell adhesion on surfaces with RGD peptides[J]. Journal of the American Chemical Society, 2005, 127: 16107–16110. DOI:10.1021/ja053648q |
| [21] | Bian Q, Wang W S, Han G X, Chen Y P, Wang S T, Wang G J. Photoswitched cell adhesion on azobenzene-containing self-assembled films[J]. Chemphyschem, 2016, 17: 2503–2508. DOI:10.1002/cphc.201600362 |
| [22] | Liu G F, Ji W, Wang W L, Feng C L. Multiresponsive hydrogel coassembled from phenylalanine and azobenzene derivatives as 3D scaffolds for photoguiding cell adhesion and release[J]. ACS Applied Materials & Interfaces, 2015, 7: 301–307. |
| [23] | Ming Z Z, Ruan X, Bao C Y, Lin Q N, Yang Y, Zhu L Y. Micropatterned protein for cell adhesion through phototriggered charge change in a polyvinylpyrrolidone hydrogel[J]. Advanced Functional Materials, 2017, 27: 1606258–1606266. DOI:10.1002/adfm.v27.25 |
| [24] | Bai T, Sinclair A, Sun F, Jain P, Hung H C, Zhang P, Ella-Menye J R, Liu W, Jiang S. Harnessing isomerization-mediated manipulation of nonspecific cell/matrix interactions to reversibly trigger and suspend stem cell differentiation[J]. Chemical Science, 2016, 7: 333–338. DOI:10.1039/C5SC03244J |
| [25] | Li W, Chen Z W, Zhou L, Li Z H, Ren J S, Qu X G. Noninvasive and reversible cell adhesion and detachment via single-wavelength near-infrared laser mediated photoisomerization[J]. Journal of the American Chemical Society, 2015, 137: 8199–8205. DOI:10.1021/jacs.5b03872 |
| [26] | Edahiro J I, Sumaru K, Tada Y, Ohi K, Takagi T, Kameda M, Shinbo T, Kanamori T, Yoshimi Y. In situ control of cell adhesion using photoresponsive culture surface[J]. Biomacromolecules, 2005, 6: 970–974. DOI:10.1021/bm0493382 |
| [27] | Higuchi A, Hamamura A, Shindo Y, Kitamura H, Yoon B O, Mori T, Uyama T, Umezawa A. Photon-modulated changes of cell attachments on poly(spiropyran-co-methyl methacrylate) membranes[J]. Biomacromolecules, 2004, 5: 1770–1774. DOI:10.1021/bm049737x |
| [28] | Dirani A, Laloyaux X, Fernandes A E, Mathy B, Schicke O, Riant O, Nysten B, Jonas A M. Reversible photomodulation of the swelling of poly(oligo(ethylene glycol) methacrylate) thermoresponsive polymer brushes[J]. Macromolecules, 2012, 45: 9400–9408. DOI:10.1021/ma302106c |
| [29] | Goldburt E, Shvartsman F, Fishman S, Krongauz V. Intramolecular interactions in photochromic spiropyran merocyanine polymers[J]. Macromolecules, 1984, 6: 1225–1230. |




