2. 大连大学 环境与化学工程学院, 辽宁 大连 116622;
3. 大连大学 辽宁省生物有机化学重点实验室, 辽宁 大连 116622
2. College of Environmental and Chemical Engineering, Dalian University, Dalian 116622, Liaoning, P. R. China;
3. Liaoning Key Laboratory of Bio-Organic Chemistry, Dalian University, Dalian 116622, Liaoning, P. R. China
血红素蛋白在生命体内部具有许多重要的生物功能,如储氧、输氧、电子传递、生物传感等[1, 2]。血红蛋白(hemoglobin, Hb)是血红素蛋白的一种,它负责高等生物体内氧的运载,主要存在于高等动物血液的红细胞中。人血红蛋白的相对分子质量约为64500,由4个亚基构成,每个亚基含有一条肽链和一个血红素分子。血红蛋白在体内有运输O2和CO2、分解H2O2、维持血液酸碱平衡等生理功能[3, 4]。血红蛋白内部的铁卟啉是环状共轭结构,能吸收特定波长的光,使蛋白的结构发生变化,进而影响蛋白生物功能的表达,因而光诱导血红素蛋白的研究引起了广泛关注[5-14]。Sakai等[6]发现在一氧化碳环境下,365 nm氙灯光能够诱导高铁血红蛋白(methemoglobin, metHb)还原生成碳氧血红蛋白(carboxyhemoglobin, HbCO),向高铁血红蛋白中添加游离色氨酸能够促进其光致还原,推测电子可能是从卟啉环转移至卟啉环中心铁。Bartocci等[15]认为血红素轴向配体是电子供体,其提供的电子发生转移从而还原了血红素铁。Masuda和Pierre等[16, 17]则认为氨基酸残基特别是色氨酸残基是光诱导还原反应的电子供体。氨基酸是组成生物体的基本物质,是构成蛋白质的结构单元,经常作为小分子配体参与到生命活动中。芳香族氨基酸(如色氨酸、苯丙氨酸)对紫外光有特定的吸收[18-20],而半胱氨酸(cysteine, Cys)是含有还原性基团巯基(—SH)的氨基酸,可通过巯基氧化情况影响蛋白质结构的稳定[21, 22]。在研究同为血红素蛋白的肌红蛋白时,发现肌红蛋白中的色氨酸和酪氨酸残基与铁卟啉基团之间可能存在激发能的转移[23];254、280 nm波长光照射氧合型肌红蛋白时,苯丙氨酸(phenylalanine, Phe)、酪氨酸(tyrosine, Tyr)、色氨酸(tryptophan, Trp)3种游离氨基酸均可促进光照氧化反应的进行[14];用254、280、409和430 nm波长光照射高铁肌红蛋白(metMb)时,含—OH或—SH基团的氨基酸(Tyr、Cys)对光照还原metMb有较好的促进作用,无—OH或—SH基团的氨基酸(Trp、Phe)对metMb的光还原作用较弱[24]。我们推断在整个光反应过程中,氨基酸可能促进了能量转移或电子传递过程[14, 23, 24]。
目前, 游离氨基酸对光诱导血红素蛋白氧化还原影响的研究虽已有相关的报道[6, 14, 24, 25],但反应机理尚不清楚,主要困惑在于光诱导反应过程中电子的转移以及在超快时间内血红蛋白的结构变化。因此,我们采用激光闪光光解和瞬态吸收光谱测定光诱导反应的动力学过程和中间体,结合紫外、荧光等稳态方法进一步研究游离半胱氨酸对光诱导血红蛋白氧化还原反应的影响及机理,力图对探究光诱导反应中的电子传递过程提供一定的参考。
1 实验部分 1.1 仪器与试剂仪器:V-560紫外-可见分光光度计(日本Jasco公司),pHS-3TC酸度计(上海雷磁分析仪器厂),LP-980激光闪光光解仪(Edinburgh Instruments, UK),FA-1004电子天平(上海精科天平厂)。
试剂:人血红蛋白(购于美国Sigma公司),其UV-Vis吸收光谱特征表明样品绝大多数为高铁血红蛋白,使用时未经进一步的提纯,将其溶解在pH=7.4、浓度为0.01 mol·L-1的磷酸盐(Na2HPO4-NaH2PO4)缓冲溶液(Phosphate buffer, PB)中,配成浓度为1×10-4 mol·L-1的储备蛋白溶液(避光4 ℃保存并尽快用于实验)。实验中所用的血红蛋白溶液浓度为2.5×10-6 mol·L-1。在0.01 mol · L-1的PB中配置浓度为0.01 mol · L-1的半胱氨酸(Cys)溶液。实验中所用氧化剂为0.1 mol·L-1的铁氰化钾(K3Fe(CN)6)溶液,还原剂为1 mol·L-1的连二亚硫酸钠(Na2S2O4)溶液,实验用水为去离子水。向一定量的高铁血红蛋白溶液中加入连二亚硫酸钠溶液(1 mol·L-1),将其还原为去氧血红蛋白(deoxyhemoglobin, deoxyHb);在定量去氧血红蛋白溶液中通入高纯O2 15 min(每秒2~3个气泡),得到氧合血红蛋白(oxyhemoglobin, HbO2);在定量去氧血红蛋白溶液中通入高纯CO 15 min(每秒2~3个气泡),得碳氧血红蛋白[26]。
1.2 实验内容 1.2.1 紫外-可见吸收光谱移取2 mL已处理好的蛋白溶液于1 cm石英比色皿中进行测定,测定条件:狭缝宽度2 nm,扫描波长范围220~700 nm,扫描速率200 nm·min-1,响应时间中等。
1.2.2 动力学瞬态吸收光谱移取2 mL已处理好的蛋白溶液于1 cm石英比色皿中,用266 nm的脉冲Nd:YAG激光照射样品;单个脉冲持续10 ns,且单个脉冲的能量从10到1 mJ,氙灯作为检测光源。激发光(266 nm)由Nd:YAG调Q激光器产生的3次和4次谐波提供,探测光由150 W氙灯提供,两束光垂直会聚在1 cm的石英比色皿上。瞬态物种信号经阵列Czerny-Turner单色仪分光,由Hamamatsu R928光电倍增管探测,最终传输到计算机终端。
1.2.3 动力学数据分析动力学瞬态吸收光谱采集时间范围为1000 ns,波长范围为250~700 nm,5 nm采集一次。为了处理和分析所测样品的动力学瞬态吸收过程相关数据,并阐明体系激发态弛豫过程的机制,通过Levenberg-Marquardt方程对所测样品瞬态吸收强度的衰减曲线进行了多指数拟合,方程表达式如下:
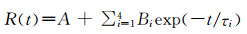
|
式中,R(t)为样品衰减过程的数学表达式,A为额外的背景常量,指前因子Bi为曲线在时间零点的振幅,τi为组分的特征寿命参数。最终拟合指数方程由较小的χ2值和τ值标准差SD确定。
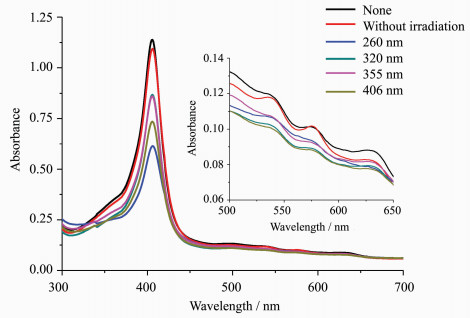
2 结果与讨论 2.1 高铁血红蛋白的光照还原反应为了研究不同波长的光照对高铁血红蛋白结构变化的影响,实验选用氙灯分出的不同定波长(260、320、355和406 nm)光照射血红蛋白样品1.5 h,测定其紫外-可见吸收光谱(图 1)。经不同波长光照后,蛋白的Soret带406 nm处特征吸收峰强度均降低并有轻微的红移,Q带537、577和630 nm处特征吸收峰明显降低,其中260 nm波长的氙灯光有较好的还原作用,其次为406 nm波长的光照。406 nm处为铁卟啉的特征Soret带吸收峰,易被铁卟啉吸收从而使铁被还原;近紫外区260、320和355 nm等波长光也可促使metHb发生还原反应,且260 nm波长光照还原作用较406 nm波长光照还原作用更强。这可能与诱导光能量的增强有关,还可能与蛋白中含有可作为电子供体促进蛋白结构变化的小分子氨基酸有关,因此我们设想在后续实验中加入游离半胱氨酸,研究其对光照反应的影响。
|
图 1 不同波长氙灯对metHb光照1.5 h后metHb紫外-可见吸收光谱的变化 Fig.1 Effects on UV-Vis absorption spectra of metHb irradiated by xenon lamp for 1.5 h at different fixed wavelengths |
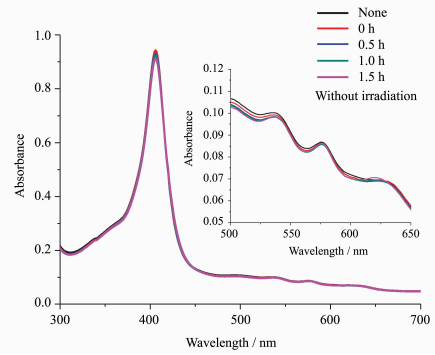
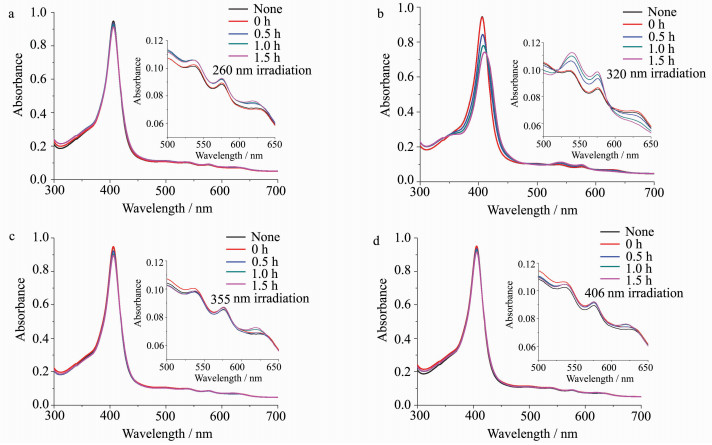
为了排除游离半胱氨酸对待测血红蛋白的紫外-可见吸收光谱可能产生的光谱叠加干扰,我们在避光条件下测定了游离半胱氨酸与血红蛋白作用1.5 h后的紫外-可见吸收光谱。与未加游离半胱氨酸血红蛋白的吸收光谱相比较,发现5条吸收光谱基本重合(图 2),这表明随着时间的延长,未光照时游离的半胱氨酸与血红蛋白基本不发生化学反应。用260、355、406 nm波长光照射加入半胱氨酸的血红蛋白溶液,随着时间的延长,Soret带406nm处的特征吸收峰基本不变,Q带537、577和630 nm处的特征吸收峰有一定的增高(图 3a、3c、3d);320 nm波长光照射加入半胱氨酸的血红蛋白溶液后,随着时间的延长,Soret带406 nm处的特征吸收峰明显降低并伴有轻微的红移,Q带537、577和630 nm处的特征吸收峰有明显升高(图 3b)。
|
图 2 加入半胱氨酸并避光1.5 h后metHb的紫外-可见吸收光谱 Fig.2 The UV-Vis absorption spectra of metHb with Cys in dark after 1.5 h |
|
图 3 加入半胱氨酸并光照1.5 h后metHb的紫外-可见吸收光谱 Fig.3 The UV-Vis absorption spectra of light irradiated metHb with Cys after 1.5 h (a) 260 nm, (b) 320 nm, (c) 355 nm, (d) 406 nm |
对比未添加半胱氨酸的光照实验,不难发现半胱氨酸有一定的维持血红蛋白结构稳定的作用。为了进一步了解半胱氨酸在光照血红蛋白实验中的作用,随后又进行了血红蛋白的激光闪光光解实验。
2.3 266 nm激光照射后血红蛋白的瞬态吸收光谱 2.3.1 血红蛋白瞬态吸收光谱为了更全面地分析了解半胱氨酸在血红蛋白光反应过程中的作用及蛋白活性中心铁卟啉结构的变化和电子转移的过程,先用266 nm激光分别照射未添加游离半胱氨酸的metHb、deoxyHb、HbO2和HbCO溶液,得到4种形态血红蛋白的瞬态吸收光谱(图 4),而后再测得添加游离半胱氨酸的metHb、deoxyHb、HbO2和HbCO的瞬态吸收光谱(图 5)。通过分析图 4的光谱数据,可知265、290和295 nm处的吸收峰为漂白峰,315和330 nm处的吸收峰为蛋白质内色氨酸激发态的吸收峰,405 nm附近为三价铁血红素的特征吸收峰,430 nm附近为二价铁血红素的特征吸收峰,415 nm附近为二价铁氧合态的特征吸收峰,420 nm附近为二价铁与CO配位的特征吸收峰。随时间延长,各波长处的瞬态吸收值峰强度均先增高后降低,metHb在598 ns时吸收峰强度最大,且总体吸收峰强度变化幅度较其他3种形态蛋白更大,deoxyHb、HbO2和HbCO分别在598、596和592 ns时吸收峰强度最大。
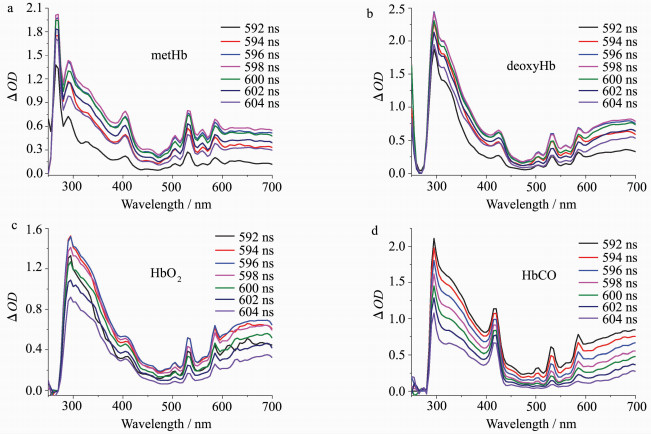
|
图 4 266 nm激光闪光光解血红蛋白不同时间的瞬态吸收光谱 Fig.4 Transient absorption spectra of Hb at different time after 266 nm laser photolysis (a) metHb, (b) deoxyHb, (c) HbO2, (d) HbCO |

|
图 5 加入半胱氨酸后对血红蛋白激光闪光光解瞬态吸收光谱的影响 Fig.5 Effects of Cys on the transient absorption spectra of Hb by laser photolysis (a) metHb, (b) deoxyHb, (c) HbO2, (d) HbCO |
血红蛋白本身有半胱氨酸,但因其包埋在其它氨基酸中,受光影响较小,因此本实验向蛋白溶液中添加游离的半胱氨酸。由于我们的设备无法发射260 nm波长的激光,因而采用266 nm脉冲激光以激发含半胱氨酸的蛋白溶液体系,进一步探究游离半胱氨酸对血红蛋白光反应过程的影响。
加入半胱氨酸后各状态血红蛋白的激光闪光光解瞬态吸收光谱如图 5所示。与未添加游离半胱氨酸的血红蛋白瞬态吸收光谱相比较,半胱氨酸显然影响了蛋白吸收峰最大强度出现的时间,deoxyHb和HbO2提前了4 ns,metHb提前了2 ns,HbCO延后了2 ns。加入游离半胱氨酸后deoxyHb内铁卟啉的Soret带特征吸收峰消失,其他形态蛋白铁卟啉的Soret带特征吸收峰位置都未发生变化,但metHb和HbO2的瞬时最高吸收峰强度明显增大,表明氨基酸与蛋白激发态之间发生了电子传递,使得卟啉环吸收峰强度增加。
2.4 激光诱导血红蛋白反应动力学过程血红蛋白的动力学衰减曲线可用于研究激光激发后血红蛋白的弛豫过程及结构变化情况(图 6),通过Levenberg-Marquardt方程对动力学衰减曲线进行多指数拟合,根据χ2值和τ值标准差SD,最终选择单指数函数,各曲线拟合参数见表 1。根据拟合数据,未添加半胱氨酸时metHb、deoxyHb、HbO2和HbCO的衰减时间都大致相同,它们的衰减过程中都出现了一个中间态,metHb中间态的存在时间较短,其他3种形态蛋白被光激发后中间体寿命较长,表明各蛋白激发中间态不同;加入半胱氨酸后,除deoxyHb衰减时间基本不变外,metHb、HbO2和HbCO激发态衰减过程明显延长,其中HbCO激发态衰减时间延长最多至23.64 ns。蛋白的动力学拟合数据表明光激发游离半胱氨酸能够影响蛋白铁卟啉的光照反应,说明加入半胱氨酸后,改变了激光诱导metHb、HbO2和HbCO衰减过程中的电子传递过程。
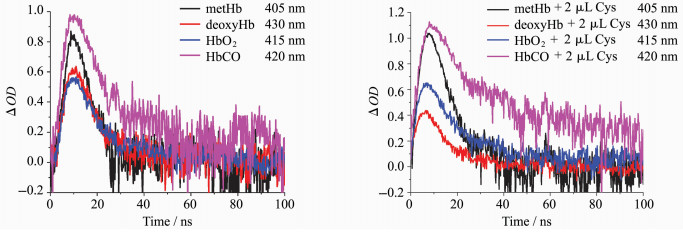
|
图 6 血红蛋白被光激发后的Soret带峰瞬态衰减曲线 Fig.6 The Soret band decay curves of Hb after photo-excitation |
| 表 1 血红蛋白被光激发后Soret带峰动力学曲线多指数拟合参数 Table 1 Multi exponential fitting parameters of the Soret band kinetic curve of Hb after photo-excitation |
激光激发前后血红蛋白的紫外-可见吸收光谱可以提供血红蛋白结构变化情况的重要信息。图 7a中未添加半胱氨酸的metHb经266 nm激光照射后,Soret带特征吸收由406 nm红移到411 nm,且吸光度明显下降,Q带538 nm处特征吸收没有明显变化,576和630 nm处特征吸收几乎消失;加入半胱氨酸的metHb经激光照射后Soret带特征吸收由406 nm红移到409 nm,且吸光度明显下降,Q带538 nm处特征吸收有明显下降,576和630 nm处特征吸收几乎消失。上述谱峰的变化情况表明半胱氨酸对光诱导metHb结构变化的影响较大。
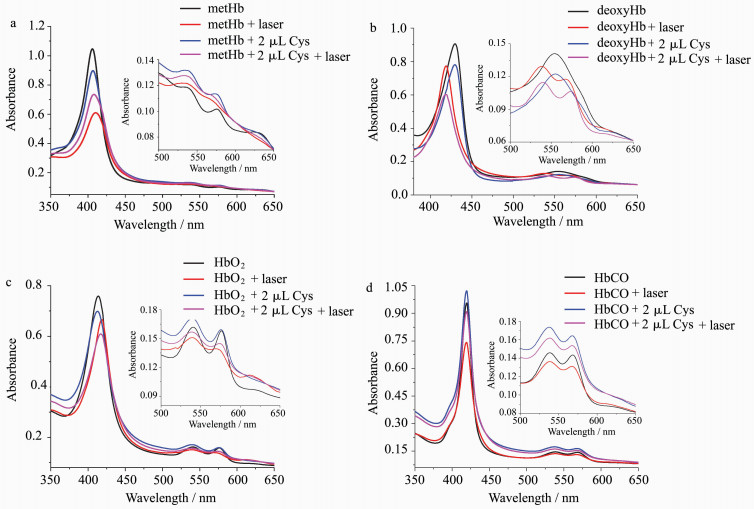
|
图 7 血红蛋白经266 nm激光闪光光解后的紫外-可见光谱 Fig.7 UV-Vis absorption spectra of Hb after 266 nm laser photolysis (a) metHb, (b) deoxyHb, (c) HbO2, (d) HbCO |
未添加半胱氨酸的deoxyHb经266 nm激光照射后,Soret带特征吸收由430 nm蓝移到419 nm,且吸光强度明显下降,Q带555 nm处特征吸收消失,在540和570 nm处形成两个新的吸收峰;加入半胱氨酸的deoxyHb经激光照射后,Soret带特征吸收由430 nm蓝移到419 nm,且吸光强度明显下降,Q带555 nm处特征吸收消失,在540和576 nm处形成两个新的吸收峰(图 7b)。综合上述谱峰的变化情况及其动力学数据,可知半胱氨酸对光诱导deoxyHb结构变化的影响较小。
HbO2的Soret带特征吸收在415 nm,Q带在540和575 nm,且吸收较强。经266 nm激光照射后Soret带特征吸收红移到了419 nm,吸光度有所减弱,Q带540和575 nm处吸收明显下降,620 nm附近有新峰出现;加入半胱氨酸的HbO2经激光照射后Soret带特征吸收红移到了418 nm,且吸光度有所减弱,Q带540和575 nm处吸收明显下降,620 nm附近有新峰的出现(图 7c)。虽然添加半胱氨酸前后蛋白谱峰的位置基本不变,但是峰的强度还是发生了一定的变化,这表明半胱氨酸对光诱导HbO2结构变化有一定的影响。
未添加色氨酸和加入色氨酸的HbCO经266 nm激光照射后,Soret带419 nm处特征吸收均未发生峰的位移,Q带538和568 nm处吸收均未发生峰的位移;但是加入半胱氨酸后,Soret带和Q带吸收峰强度明显增强(图 7d)。由蛋白谱峰的变化情况和动力学数据可知HbCO的结构相对较为稳定,不管蛋白中是否添加半胱氨酸,在266 nm激光激发后,蛋白总体结构几乎不发生变化。这是由于CO配位的铁卟啉较为稳定,不与半胱氨酸发生电子转移,因而会出现加入色氨酸后其激发态衰减有较大延长的情况。
2.6 激光诱导血红蛋白结构变化的机制综合上述图谱可知,血红蛋白的初始形态尽管大不相同,但在光照后其铁卟啉光谱均发生了明显变化。未加入半胱氨酸光照,除metHb的576 nm处峰以肩峰形式出现外,其余各峰变化趋于相同;加入半胱氨酸后光照,各血红蛋白的Soret带谱峰和Q带的谱峰,无论峰型、峰位置或峰的强度,均趋至一个方向,且加入半胱氨酸对光照反应影响明显,趋向性更强。以上结果表明,无论何种形态的血红蛋白,光照反应后均趋向于同一个异于上述4种蛋白的结构。为此我们推测了激光诱导metHb、deoxyHb、HbO2和HbCO结构变化的可能机理,见图 8。
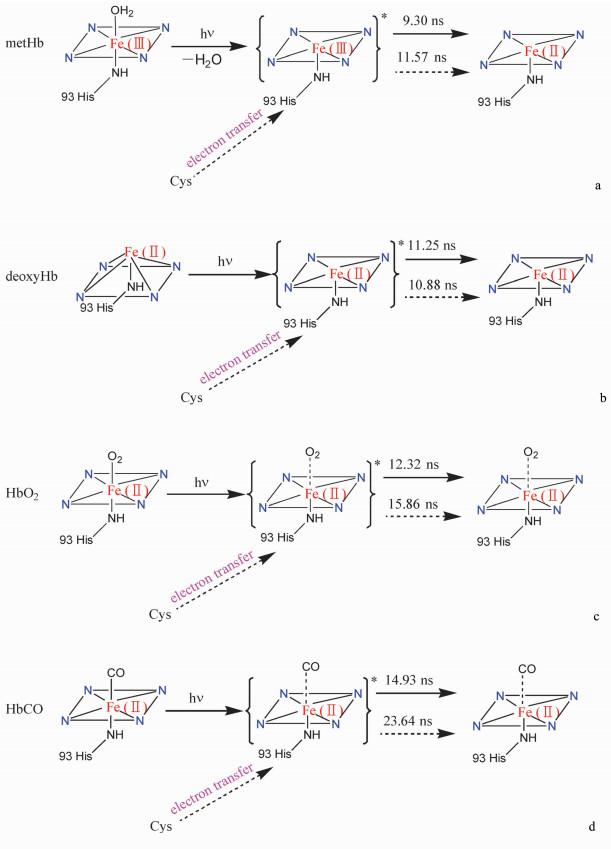
|
图 8 光诱导血红蛋白发生反应的机理 Fig.8 Photo-induced reaction mechanism of Hb (a) metHb, (b) deoxyHb, (c) HbO2, (d) HbCO |
未加氨基酸的metHb经激光照射,卟啉环π电子被激发到激发态,电子较为活跃,转移到三价铁中未满的d轨道上,形成二价铁卟啉;由于添加的半胱氨酸中的S原子富含电子,光照致使其发生电子转移至激发态卟啉环,再转移电子到三价铁中未满的d轨道上,形成二价铁卟啉,最终metHb的铁卟啉形成具有一空位的六配位平面构型(图 8a)。DeoxyHb中的亚铁具有五配位结构,铁与卟啉的4个N不在同一平面上,光照激发卟啉后,卟啉形成激发态平面型结构,再经弛豫返回基态,保留具有一空位的六配位平面构型(图 8b)。HbO2的第六配位为O2分子,光照后铁卟啉至激发态,O2由于缺少反馈π键,卟啉π电子被激发,致使Fe—O配位键增长,配位能力减弱,O2呈离去(或半离去)状态,铁卟啉转为具有一空位的六配位平面结构(图 8c)。HbCO的第六配位为CO分子,由于Fe与C之间存在反馈π键,致使二者配位结合力较强,CO不易离去,但光照铁卟啉至激发态后,使Fe—C配位键增长,CO呈半离去状态,铁卟啉近似为具有一空位的六配位平面构型(图 8d)。综上所述,游离半胱氨酸会影响血红蛋白的光诱导反应。当光照射含有游离半胱氨酸的血红蛋白时,均因半胱氨酸与激发态的卟啉环发生电子传递,促使各种状态血红蛋白光照反应至铁卟啉具有一空位的六配位平面结构状态。
3 结论通过紫外-可见光谱法研究光照条件下高铁血红蛋白的光谱性质,发现经260、320、355和406 nm波长光照射,均会引起高铁血红蛋白的结构变化,且260 nm紫外光较易激发铁卟啉发生光照还原过程,而卟啉Soret带最大吸收波长光被吸收后较难激发铁卟啉;加入半胱氨酸后,260、355和406 nm波长光照射下,高铁血红蛋白的结构变化不大,只有320 nm波长光照后,高铁血红蛋白的结构发生了明显变化,这表明游离半胱氨酸有助于光照实验中高铁血红蛋白结构的稳定。运用266 nm激光闪光光解光谱法研究不同形态的血红蛋白(metHb、deoxyHb、HbO2和HbCO)的动力学过程,发现在未添加游离半胱氨酸时,metHb、deoxyHb、HbO2和HbCO的衰减时间大致相同;而加入游离半胱氨酸后,除deoxyHb衰减时间基本不变外,metHb、HbO2和HbCO的衰减时间均有不同程度延长。加入的游离半胱氨酸可能影响了metHb、HbO2和HbCO激发态衰减过程中的电子传递过程。游离半胱氨酸存在时,因其与各状态卟啉均可发生电子传递,促使各种状态血红蛋白光照反应至铁卟啉具有一空位的六配位平面结构的状态。这些实验结果将有助于研究者深入了解光诱导血红蛋白反应的动力学过程和电子传递过程。
| [1] | Lu Y, Berry S M, Pfister T D. Engineering novel metalloproteins:design of metal-binding sites into native protein scaffolds[J]. Chemical Reviews, 2001, 101(10): 3047–3080. DOI:10.1021/cr0000574 |
| [2] | Rodgers K R. Heme-based sensors in biological systems[J]. Current Opinion in Chemical Biology, 1999, 3(2): 158–167. DOI:10.1016/S1367-5931(99)80028-3 |
| [3] | Baldwin J M. Structure and function of haemoglobin[J]. Progress in Biophysics & Molecular Biology, 1975, 29(3): 225–320. |
| [4] | Chang T M S. Blood substitutes based on nanobiotechnology[J]. Trends in Biotechenology, 2006, 24(8): 372–377. DOI:10.1016/j.tibtech.2006.06.005 |
| [5] | Mauk M R, Girotti A W. Photooxidation of the protoporphyrin-apomyoglobin complex[J]. Biochemistry, 1973, 12(17): 3187–3193. DOI:10.1021/bi00741a007 |
| [6] | Sakai H, Onuma H, Umeyama M, Takeoka S, Tsuchida E. Photoreduction of methemoglobin by irradiation in the near-ultraviolet region[J]. Biochemistry, 2000, 39(47): 14595–14602. DOI:10.1021/bi0014204 |
| [7] | Winterle J S, Einarsdóttir Í. Photoreactions of cytochrome C oxidase[J]. Photochemistry and Photobiology, 2006, 82(3): 711–719. DOI:10.1562/2005-09-14-RA-684 |
| [8] | Liang X Q, Chen G F, Zhang X, Liu S L, Li G X. Study of UVA irradiation on hemoglobin in the presence of NADH[J]. Journal of Photochemistry and Photobiology B:Bio-logy, 2008, 90(1): 53–56. DOI:10.1016/j.jphotobiol.2007.11.001 |
| [9] | Munk M B, Huvaere K, Bocxlaer J V, Skibsted L H. Mechanism of light-induced oxidation of nitrosylmyoglobin[J]. Food Chemistry, 2010, 121(2): 472–479. DOI:10.1016/j.foodchem.2009.12.067 |
| [10] | Hersleth H P, Andersson K K. How different oxidation states of crystalline myoglobin are influenced by X-rays[J]. Biochimica et Biophysica Acta, 2011, 1814(6): 785–796. DOI:10.1016/j.bbapap.2010.07.019 |
| [11] |
周华伟, 曹洪玉, 唐乾, 安良梅, 郑学仿. 光诱导高铁肌红蛋白还原的光谱法研究[J]. 化学学报, 2011, 69(13): 1559–1564.
Zhou H W, Cao H Y, Tang Q, An L M, Zheng X F. Spectral study on the photoreduction of metmyoglobin[J]. Acta Chimica Sinica, 2011, 69(13): 1559–1564. |
| [12] |
安良梅, 曹洪玉, 唐乾, 郑学仿. 紫外光照下高铁肌红蛋白的还原[J]. 无机化学学报, 2012, 28(7): 1461–1468.
An L M, Cao H Y, Tang Q, Zheng X F. Photoreduction of metmyoglobin by ultraviolet irradiation[J]. Chinese Journal of Inorganic Chemistry, 2012, 28(7): 1461–1468. |
| [13] |
刘艳伟, 曹洪玉, 唐乾, 郑学仿. 大分子拥挤条件下光诱导细胞色素C还原的光谱研究[J]. 化学学报, 2014, 72(2): 246–252.
Liu Y W, Cao H Y, Tang Q, Zheng X F. Spectral study on the photoreduction of cytochrome c under macromolecular crowding[J]. Acta Chimica Sinica, 2014, 72(2): 246–252. |
| [14] |
曹洪玉, 高凌星, 唐乾, 苏晋红, 郑学仿. 紫外光诱导氧合型肌红蛋白氧化反应及机理[J]. 物理化学学报, 2016, 32(4): 872–878.
Cao H Y, Gao L X, Tang Q, Su J H, Zheng X F. Mechanism of oxymyoglobin oxidation reaction induced by ultra-violet light[J]. Acta Physico-Chimica Sinica, 2016, 32(4): 872–878. DOI:10.3866/PKU.WHXB201601046 |
| [15] | Bartocci C, Maldotti A, Carassiti V, Traverso O, Ferri A. Intramolecular photoredox reactins in iron (Ⅲ) cytochrome c and its azide derivative[J]. Inorganica Chimica Acta, 1985, 107(1): 5–12. DOI:10.1016/S0020-1693(00)80681-7 |
| [16] | Masuda T, Minemura A, Yamauchi K, Kondo M. A mechanism of direct photoreduction of ferricytochrome c[J]. Journal of Radiation Research, 1980, 21(2): 149–156. DOI:10.1269/jrr.21.149 |
| [17] | Pierre J, Bazin M, Debey P, Santus R. One-electron photoreduction of bacterial cytochrome P-450 by ultraviolet light[J]. European Journal of Biochemistry, 1982, 124(3): 533–537. |
| [18] | Bent D V, Hayon E. Excited state chemistry of aromatic amino acids and related peptides. Ⅲ. Tryptophan[J]. Journal of the American Chemical Society, 1975, 97(10): 2612–2619. DOI:10.1021/ja00843a004 |
| [19] | Bent D V, Hayon E. Excited state chemistry of aromatic amino acids and related peptides. Ⅱ. Phenylalanine[J]. Journal of the American Chemical Society, 1975, 97(10): 2606–2612. DOI:10.1021/ja00843a003 |
| [20] | Creed D. The Photophysics and photochemistry of the near-UV absorbing amino acids. Ⅰ. Tryptophan and it's simple derivatives[J]. Photochemistrv and Phorobiology, 1984, 39(4): 537–562. |
| [21] | Darkwa J, Mundoma C, Simoyi R H. Antioxidant chemistry reactivity and oxidation of DL-cysteine by some common oxidants[J]. Journal of the Chemical Society, Faraday Transactions, 1998, 94(14): 1971–1978. DOI:10.1039/a708863i |
| [22] | Wang Y, Yang J, Yi J. Redox sensing by proteins:oxidative modifications on cysteines and the consequent events[J]. Antioxidants & Redox Signaling, 2012, 16(7): 649–657. |
| [23] |
马君燕, 郑学仿, 郭明, 唐乾, 马静, 高大彬, 胡皆汉. 荧光法研究光诱导肌红蛋白的去氧过程[J]. 中国科学(B辑:化学), 2008, 38(1): 55–59.
Ma J Y, Zheng X F, Guo M, Tang Q, Ma J, Gao D B, Hu J H. Research on the deoxygenization of myoglobin under photo-induced by fluorescence spectroscopy[J]. Science in China Series B:Chemistry, 2008, 38(1): 55–59. |
| [24] |
曹洪玉, 郭相金, 唐乾, 史珊珊, 王珍, 郑学仿. 游离芳香氨基酸和半胱氨酸对光诱导高铁肌红蛋白还原的影响[J]. 化学通报, 2015, 78(9): 829–837.
Cao H Y, Guo X J, Tang Q, Shi S S, Wang Z, Zheng X F. Effect of free aromatic amino acids and cysteine on photoreduction of met-myoglobin[J]. Chemistry, 2015, 78(9): 829–837. |
| [25] | Cao H Y, Liu Y W, Tang Q, Zhao J M, Guo X J, Zheng X F. Spectroscopic insights into the photoreduction of cytochrome c with UVA-Vis light irradiation[J]. Protein and Peptide Letters, 2015, 22(9): 853–859. DOI:10.2174/0929866522666150707115231 |
| [26] | Zwart A, Buursma A, van Kampen E J, Zijlstra W G. Multicomponent analysis of hemoglobin derivatives with a reversed-optics spectrophotometer[J]. Clinical Chemistry, 1984, 30(3): 373–379. |




