2. 山东大学 晶体材料国家重点实验室, 山东 济南 250100
2. State Key Laboratory of Crystal Materials, Shandong University, Ji'nan 250100, Shandong, P. R. China
α-氨基酸是构成蛋白质的基本单元,是人体的重要营养物质。如谷氨酸和天门冬氨酸有利于保护肝脏、改善儿童智力发育以及调节神经代谢,可用于治疗消化道、呼吸道疾病及心血管疾病等,在人体生命活动中至关重要[1]。然而,体内过多谷氨酸和天门冬氨酸则会诱发严重的神经元损伤,引起眼睛和皮肤发炎[2]。因此,实时检测谷氨酸和天门冬氨酸具有重要的生化意义。
目前,用于α-氨基酸检测的方法主要有电化学[3]、核磁共振波谱[4]和高效液相色谱[5]等,但其检测对仪器依赖性较大、前处理复杂、设备昂贵、用途单一、耗时长[6],限制了其广泛应用。近年来,荧光检测α-氨基酸引起了学者们的广泛青睐[7-9]。由于具有选择性好、灵敏度高、响应快速以及易于操作等优势,用荧光化学传感器检测α-氨基酸已成为热点研究领域之一。2015年,朱为宏教授小组[7]首次报道了一种BODIPY双重响应荧光探针,可在活体中选择性检测出半胱氨酸(Cys)、血同型半胱氨酸(Hcy)和谷胱甘肽(GSH);在可见光激发下可获得两个数量级的荧光增强。此外,还可将后者与前两者有效地区别性检测。2007年,朱成建教授小组[8]报道了一种含N稠杂环的荧光探针在DMSO溶剂中可选择性检测半胱氨酸(Cys)和血同型半胱氨酸(Hcy),在可见光激发下可获得75倍增强的红色双光子荧光。
本文以自制的罗丹明6G螺环酰肼为荧光探针分子,在人体生理条件下(水相,pH=7), 检测了20种α-氨基酸,并通过比较这20种α-氨基酸的等电点,分析了罗丹明6G螺环酰肼探针分子对谷氨酸和天门冬氨酸具有选择性和高灵敏性荧光响应的原因。
1 实验部分 1.1 试剂与仪器罗丹明6G、无水乙醇和氨基酸(均为市售分析纯),水合肼(80%),蒸馏水为二次蒸馏制得。
FLS 920型稳态荧光光谱仪(爱丁堡公司);UV-2600紫外-可见分光光度计(日本SHIMADZU公司);AVANCE-Ⅲ核磁共振光谱仪(瑞士Bruker公司);INOVA400(EI)型质谱仪(瑞士Bruker公司)。
1.2 罗丹明螺环酰肼合成[10]称取罗丹明6G(2.40 g,5.0 mmol)于100 mL三口烧瓶内,加入60 mL乙醇将其溶解。磁力搅拌下,逐滴滴加8.0 mL(过量)水合肼(80%),反应回流约2 h。逐渐冷却至室温,有白色沉淀产生,减压抽滤后用35 mL乙醇/水溶液(1:1, V/V)分别洗涤3次,可得淡粉色粉末粗产品;粗产物经柱层析分离提纯,流动相为石油醚:乙酸乙酯=1:1(V/V),可得淡粉色罗丹明6G酰肼(1.90 g,88.6%)。1HNMR (400 MHz,CDCl3):7.98(m,1H),7.49~7.47(m,2H),7.08(m,1H),6.41(s,2H),6.28(s,2H),3.57(br,4H),3.24(q,J=7.2 Hz,4H),1.94(s,6H),1.34(t,J=7.2 Hz,6H)。13CNMR(400 MHz,CDCl3):166.2,152.2,151.7,147.5,132.5,129.8,128.1,127.6,123.8,123.0,117.9,104.8,96.9,66.0,38.3,16.7,14.7。Mass(ESI:m/z)[M+H]+ for C26H29N4O2 : calcd 429.2291,found: 429.2289。
1.3 样品测试将罗丹明6G螺环酰肼溶解在1.0 mmol/L的DMF溶液中,然后稀释。氨基酸选择性实验和光谱实验时所用浓度为10 μmol/L。检测时, 将谷氨酸和天门冬氨酸加入探针溶液(10 μmol/L)中,充分震荡后,迅速记录λex=500 nm、λem=550 nm的荧光信号。
除图 1中的吸收光谱和荧光光谱使用的溶剂为二甲基亚砜(DMSO),其余检测中均使用混合溶剂(DMF/H2O=1/99,V/V)。缓冲溶液为Na2HPO4(0.2 mol/L)/NaH2PO4(0.3 mol/L): 61/39(V/V),pH=7。
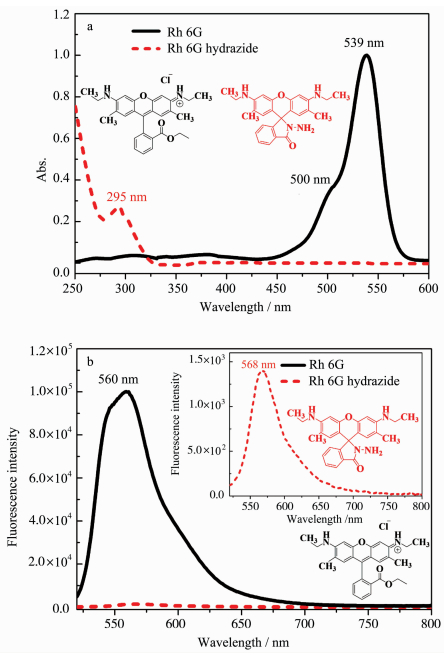
|
图 1 罗丹明6G和罗丹明6G酰肼的吸收光谱(a)和荧光发射光谱(b)(浓度均为10 μmol/L,溶剂为DMSO,荧光激发波长为500 nm) Fig.1 The UV-Vis absorption (a) and fluorescence (b) spectra of rhodamine 6G and rhodamine 6G hydrazide in DMSO under the concentration of 10 μmol/L |
图 1(a)为罗丹明6G酰肼(螺环)和罗丹明6G(开环)的紫外-可见吸收光谱图。由图可知,在二甲基亚砜(DMSO)溶剂中,罗丹明6G溶液呈橘红色,其吸收带为450~560 nm,最大吸收峰位于539 nm,而成环后的罗丹明6G酰肼溶液呈无色透明状,吸收峰蓝移至紫外区295 nm,在可见光区无明显吸收峰。罗丹明6G和罗丹明6G酰肼的吸收光谱性质差异主要是由分子的共轭效应引起的,罗丹明6G为开环结构,共轭程度提高,π电子的离域作用增大,使得吸收带的峰位红移并伴随着增色效应;而罗丹明酰肼为螺环化合物,共轭程度降低,π电子的离域作用减小,使得吸收带的峰位蓝移并伴随着减色效应。
由图 1(b)可知,在二甲基亚砜(DMSO)溶剂中,罗丹明6G酰肼在520~800 nm之间几乎没有显示出较明显的荧光峰,整体表现出无色、低荧光状态;罗丹明6G的荧光发射峰则主要位于560 nm,整体呈橘红色、高荧光状态。对比相同浓度的罗丹明6G和罗丹明6G酰肼的发射峰强度,可以明显观察到在520~800 nm之间罗丹明6G酰肼的发射峰强度非常弱,其溶液呈无色透明状态。本文选择罗丹明6G酰肼作为荧光探针,主要是利用荧光探针与外来物相互作用引起分子的荧光性质(主要为荧光强度)发生显著变化这一原理,无色、低荧光状态的罗丹明6G酰肼在与外来物种相互作用后可生成显色、高荧光状态的开环产物罗丹明6G。
2.2 选择性吸收-荧光探测研究 2.2.1 吸收光谱与比色检测在罗丹明6G酰肼溶液(10 μmol/L)中分别滴加不同的氨基酸(100 μmol/L),吸收光谱并未观察到明显变化(见图 2a)。另外,在罗丹明6G酰肼(10 μmol/L)中分别滴加不同浓度(0~500 μmol/L)的谷氨酸和天门冬氨酸,吸收光谱也并未观察到明显变化(见图 2b和2c)。可见,在该浓度下无法用吸收光谱法来检测氨基酸。
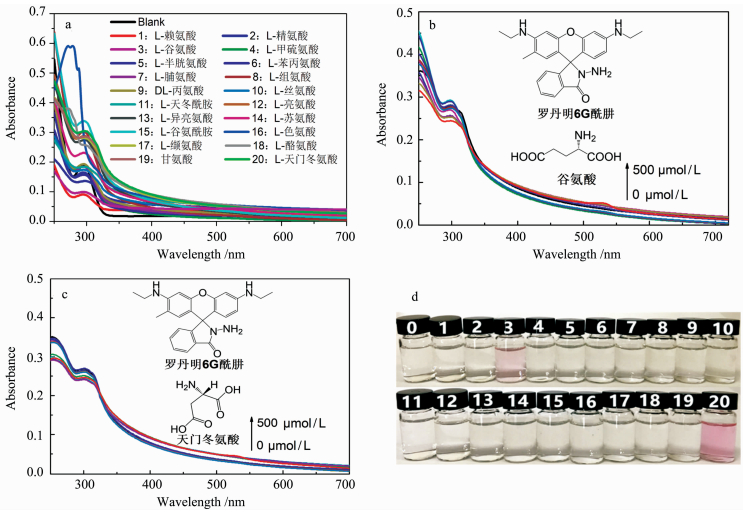
|
图 2 (a) 罗丹明6G酰肼(10 mol/L)在不同氨基酸(100 μmol/L)存在下的紫外-可见吸收光谱, (b)罗丹明6G酰肼(10 μmol/L)在不同浓度谷氨酸存在下的紫外-可见吸收光谱, (c)罗丹明6G酰肼(10 μmol/L)在不同浓度的天门冬氨酸存在下的紫外-可见吸收光谱, (d)罗丹明6G酰肼(0.5 mmol/L)对20种氨基酸(2 mmol/L)的比色实物图 Fig.2 UV-Vis absorption spectra of rhodamine 6G hydrazide (10 μmol/L) with (a) different amino acids (100 μmol/L), (b) glutamic acid (0-500 μmol/L), (c) aspartic acid(0-500 μmol/L) and (d) color response of rhodamine 6G hydrazide (0.5 mmol/L) upon different α-amino acids (2 mmol/L). Solvent: DMF/H2O=1/99, V/V, pH=7 |
进一步增加罗丹明6G酰肼和氨基酸的浓度分别至0.5 mmol/L和2 mmol/L,探针分子对α-氨基酸的比色识别显著增强,如图 2d所示。在20种氨基酸溶液中,只有3号(谷氨酸)和20号(天门冬氨酸)溶液的颜色由无色变为粉红色。说明谷氨酸和天门冬氨酸与探针分子发生了相应的反应,导致颜色发生变化。由于比色目测法添加底物浓度较大,检测灵敏度不高,且紫外-可见分光光度法检测谷氨酸灵敏度低,吸收光谱严重重叠,实验中采用荧光测试可进一步提高灵敏度。
2.2.2 荧光性能变化在罗丹明6G酰肼溶液(10 μmol/L)中分别滴加20种不同的氨基酸,检测其荧光强度的变化,如图 3所示。可见在氨基酸的浓度为100 μmol/L时,均检测出有不同程度的荧光,但仅有谷氨酸和天门冬氨酸这两种氨基酸能引起罗丹明6G酰肼荧光强度的显著增强,滴加其它18种氨基酸的光谱图几乎没有明显增强。测试中若将背景荧光加以扣除,则可以看出,罗丹明6G酰肼对谷氨酸和天门冬氨酸具有很好的荧光响应,因此探针罗丹明6G酰肼对谷氨酸和天门冬氨酸表现出高选择性。

|
图 3 罗丹明6G酰肼(10 μmol/L)对不同氨基酸(100 μmol/L)的荧光响应 1:L-赖氨酸,2:L-精氨酸,3:L-谷氨酸,4:L-甲硫氨酸,5:L-半胱氨酸,6:L-苯丙氨酸,7:L-脯氨酸,8:L-组氨酸,9:DL-丙氨酸,10:L-丝氨酸,11:L-天冬酰胺,12:L-亮氨酸,13:L-异亮氨酸,14:L-苏氨酸,15:L-谷氨酰胺,16:L-色氨酸,17:L-缬氨酸,18:L-酪氨酸,19:甘氨酸,20:L-天门冬氨酸 Fig.3 Fluorescence responses of rhodamine 6G hydrazide (10 μmol/L) to different amino acids (100 μmol/L) 1: L-lysine, 2: L-arginine, 3: L-glutamic acid, 4: L-methionine, 5: L-cysteine, 6: L-phenylalanine, 7: L-proline, 8: L-histidine, 9: DL-alanine, 10: L-serine, 11: L-asparagine, 12: L-leucine, 13: L-isoleucine, 14: L-threonine, 15: L-glutamine, 16: L-tryptophan, 17: L-valine, 18: L-tyrosine, 19: glycine, 20: L-aspartic acid |
为了确定探针分子检测氨基酸的适宜pH环境,检测了罗丹明螺环酰肼(10 μmol/L)的荧光强度随pH值的变化(测试条件λex=500 nm,λem=550 nm)。由图 4可见,在pH=6时几乎没有荧光;在pH 5.5时出现非常强的荧光,说明在酸性条件下,该探针分子螺环结构不稳定,发生了异构化反应生成开环态[10],导致明显的荧光出现。有意义的是,在pH=6~8之间,并没有观察到明显的荧光信号,这说明在此pH值范围,罗丹明的螺环结构比较稳定,从而确定了探针的荧光检测可选定在pH=7中性环境,这对生理条件下的理化检测具有重要意义。
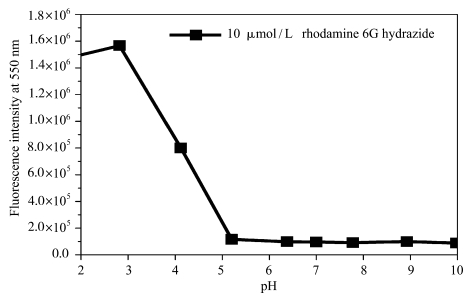
|
图 4 罗丹明螺环酰肼(10 μmol/L)在不同pH下的荧光强度(溶剂:DMF/H2O=1/99, V/V, 检测条件:λex=500 nm,λem=550 nm) Fig.4 The fluorescence intensity of rhodamine hydrazide (10 μmol/L) under different pH value (solvent: DMF/H2O=1/99, V/V, λex=500 nm, λem=550 nm) |
图 5为探针的荧光光谱随谷氨酸和天门冬氨酸浓度增大而发生的变化,随着谷氨酸浓度增大,探针的荧光峰强度显著增强,如谷氨酸的浓度分别为1 μmol/L、10 μmol/L和100 μmol/L时,对应的探针荧光强度分别增加了0.69%、9.77%和294.31%。类似地,随着天门冬氨酸浓度增加,探针的荧光峰强度显著增强,如天门冬氨酸的浓度分别为1 μmol/L、10 μmol/L和100 μmol/L时,探针的荧光强度分别增加0.83%、6.02%、114.60%。

|
图 5 谷氨酸(a)和天门冬氨酸(b)存在下,罗丹明6G酰肼(10 μmol/L)的荧光光谱 Fig.5 Fluorescence spectra of rhodamine 6G(10 μmol/L)with glutamic acid (a) and aspartic acid (b) DMF/H2O=1/99, V/V, pH=7, λex=500 nm, λem=550 nm |
图 6为体系相对荧光强度F/F0随谷氨酸和天门冬氨酸浓度变化而发生的变化。当氨基酸浓度在0~10 μmol/L之间时,分别对两个体系的相对荧光强度F/F0进行拟合,可得到两条线性相关性很好的工作曲线,相关系数分别为(a)k=0.0107,R2=0.9963和(b)k=0.0057,R2=0.9966。依据公式LOD(limit of detection)=3δ/k[11](δ为空白溶液的相对标准偏差,k为校准曲线的斜率)计算出罗丹明6G酰肼分子对谷氨酸和天门冬氨酸的检测限分别为0.07 μmol/L和0.14 μmol/L,证明该分子对谷氨酸和天门冬氨酸都表现出较高的检测灵敏度和准确性。
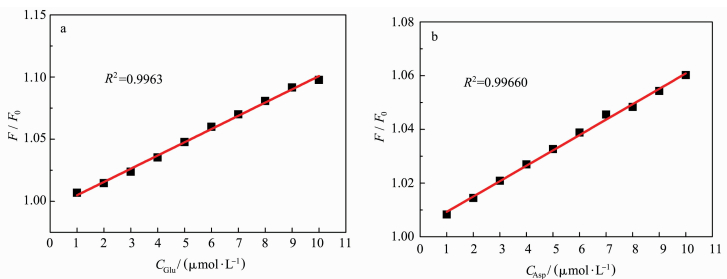
|
图 6 相对荧光强度F/F0与谷氨酸(a)和天门冬氨酸(b)浓度变化的线性关系 Fig.6 Linear relationship between relative fluorescence intensity F/F0 and concentration of glutamic acid(a) and aspartic acid(b) DMF/H2O=1/99, V/V, pH=7, λex=500 nm, λem=550 nm |
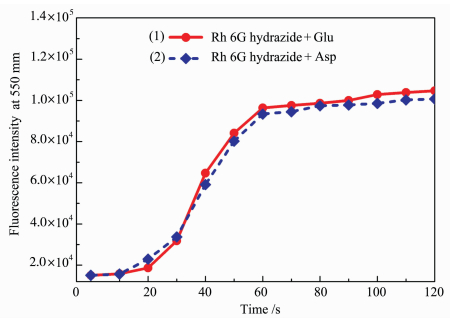
本文对2 min内的响应进行进一步研究,如图 7所示,罗丹明6G酰肼与谷氨酸和天门冬氨酸均可在2 min内迅速反应完全,并达到稳定状态。此结果表明探针罗丹明6G酰肼可以迅速捕获谷氨酸和天门冬氨酸,且反应产物具有光稳定性。荧光探针和反应产物的稳定性确保了实验方法的可靠性,可获得高灵敏度和可重复性的结果。
2.5 荧光探针检测机理由图 4可见,罗丹明6G酰肼在pH>5时较为稳定,而在pH<5的介质中即出现不同程度甚至很强的荧光,这说明该探针分子螺内酰胺结构在偏酸性溶液中不稳定,生成大共轭度的开环结构,此时体系出现橘红色并伴有较强的荧光[12]。
|
图 7 罗丹明6G酰肼-氨基酸反应体系的荧光强度随时间变化趋势 (1)罗丹明6G酰肼(10 μmol/L)和谷氨酸(10 μmol/L),(2)罗丹明6G酰肼(10 μmol/L)和天门冬氨酸(10 μmol/L) Fig.7 Changes in fluorescence intensity of rhodamine 6G hydrazine-amino acid reaction system changes with time rhodamine 6G hydrazide (10 μmol/L), (1) rhodamine 6G hydrazide (10 μmol/L) and glutamic acid (10 μmol/L), (2) rhodamine 6G hydrazide (10 μmol/L) and aspartic acid (10 μmol/L) λex=500 nm, λem=550 nm |
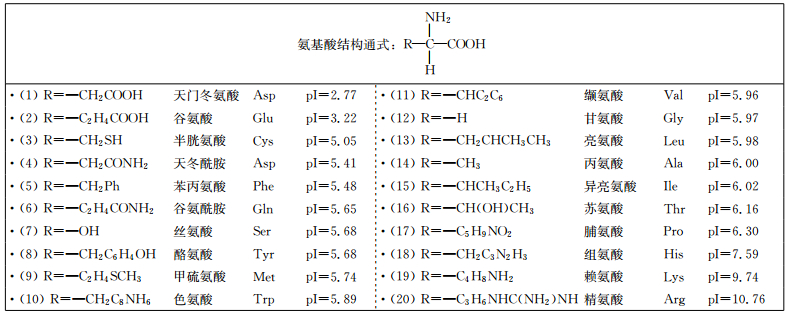
由于人体中20种α -氨基酸结构不同,所呈现的等电点(pI)也不同,水溶液中氨基酸的电离形式和离子存在形式均不相同。在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势或程度相等时,此时溶液的pH值即为该氨基酸的等电点。当外界溶液的pH大于氨基酸pI值时,此时氨基酸释放质子带负电。当外界溶液的pH小于氨基酸的pI值,氨基酸质子化带正电。人体中20种α-氨基酸结构式及等电点如图 8所示。
|
图 8 人体中20种α-氨基酸结构式及等电点 Fig.8 Structural formula and isoelectric point of 20 kinds of α-amino acids in human body |
以谷氨酸为例,其pI=3.22,在人体生理条件下(pH=7),谷氨酸以单阴离子形式存在[12],并电离出H+。当罗丹明探针遇到外来物种谷氨酸时,谷氨酸电离出的H+会诱导探针的螺内酰胺环打开形成开环结构(如图 9所示)[13, 14],相应的体系即发出荧光。

|
图 9 罗丹明6G酰肼与谷氨酸作用机理 Fig.9 Reaction mechanism of rhodamine 6G hydrazide and glutamic acid |
本文罗丹明6G酰肼与天门冬氨酸相互作用的机理也如上所述。
3 结论以罗丹明6G为主体分子,制备了罗丹明6G酰肼作为荧光探针,在DMF/H2O的混合溶液中、500 nm波长激发下,探针分子的螺内酰胺部分处于闭环状态,整体分子无色、无荧光。随着体系中特定分析物谷氨酸和天门冬氨酸浓度的不断增加,酰胺环被诱导打开,体系颜色变化明显,出现强烈的绿光荧光(峰位在550 nm),荧光强度呈线性增强。实验所用的其它18种人体基本氨基酸与荧光化学传感器几乎没有响应。因而本文实现了对谷氨酸和天门冬氨酸的识别响应,检测限分别可达7×10-8 mol/L和1.4×10-7 mol/L。这一结果证实罗丹明6G酰肼作为荧光探针,可快速实现对谷氨酸和天门冬氨酸的选择性和高灵敏度荧光检测。
| [1] |
邱瑜, 陈红专, 金正均. 谷氨酸神经细胞毒作用的新途径——谷氨酸/胱氨酸转运体介导机制[J]. 中国药理学通报, 2000, 16(3): 251–253.
Qiu Y, Chen H Z, Jin Z J. The new pathway of glutamic nerve cell toxicity:glutamic/cysteine transporter mediated mechanism[J]. Chinese Pharmacological Bulletin, 2000, 16(3): 251–253. |
| [2] |
陈莎莎, 刘希江, 许爱军, 曹菲, 田玉科. 骨癌痛大鼠脑脊液谷氨酸含量的检测及意义[J]. 实用医学杂志, 2010, 26(9): 1512–1514.
Chen S S, Liu X J, Xu A J, Cao F, Tian Y K. Detection and significance of cerebrospinal fluid glutamic in rats with bone cancer[J]. The Journal of Practical Medicine, 2010, 26(9): 1512–1514. |
| [3] |
刘建芳, 侯艳宁, 刘会臣. 柱前衍生-电化学检测HPLC法测定大鼠脑内的谷氨酸和γ-氨基丁酸[J]. 解放军药学学报, 2000, 16(6): 299–302.
Liu J F, Hou Y N, Liu H C. Determination of glutamic and gamma-aminobutyric acid in rats brain by electrochemical detection HPLC[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2000, 16(6): 299–302. |
| [4] |
叶欣, 于健春, 冯逢, 何桂珍, 樊跃平, 胡凌, 孙非, 金征宇. 1H磁共振波谱无创检测手术创伤前后新西兰兔后肢肌肉谷氨酰胺、谷氨酸的总含量[J]. 中国医学科学院学报, 2008, 30(2): 201–207.
Ye X, Yu J C, Fen F, He G Z, Fan Y P, Hu L, Sun F, Jin Z Y. The total content of the glutamine and glutamic in the hind limbs of New Zealand rabbits, muscle before and after the trauma of the operation of 1H magnetic resonance spectroscopy[J]. Acta Academiae Medicinae Sinicae, 2008, 30(2): 201–207. |
| [5] |
李新玲, 李炳源. 高效液相色谱法检测玻璃体中的谷氨酸研究[J]. 南通大学学报(医学版), 2006, 26(4): 272–273.
Li X L, Li B Y. The study of glutamic acid in vitreous body was detected by HPLC[J]. Journal of Nantong University:Medical Sciences, 2006, 26(4): 272–273. |
| [6] |
吴健, 邓留杰, 郭利芬, 周新钦, 廖洛, 段广才, 李季伦. 毛细管电泳法检测转化液中谷氨酰胺和谷氨酸[J]. 食品科学, 2008, 29(4): 328–331.
Wu J, Deng L J, Guo L F, Zhou X X, Liao L, Duan G C, Li J L. Transglutaminamide and glutamic acid were detected by capillary electrophoresis[J]. Food Science, 2008, 29(4): 328–331. |
| [7] | Wang F Y, Zhou L, Zhao C C, Wang R, Fei Q, Luo S H, Guo Z Q, Tian H, Zhu W H. A dual-response BODIPY-based fluorescent probe for the discrimination of glutathione from cystein and homocystein[J]. Chemical Science, 2015, 6(4): 2584–2589. DOI:10.1039/C5SC00216H |
| [8] | Hou J L, Song F Y, Wang L, Guo W, Cheng Y X, Zhu C J. In situ generated 1:1 Zn(Ⅱ)-containing polymer complex sensor for highly enantioselective recognition of N-Boc-protected alanine[J]. Macromolecules, 2012, 45(19): 7835–7842. DOI:10.1021/ma301553y |
| [9] | Zhang M, Yu M X, Li F Y, Zhu M W, Li M Y, Gao Y H, Li L, Liu Z Q, Zhang J P, Zhang D Q, Yi T, Huang C H. A highly selective fluorescence turn-on sensor for cysteine/homocysteine and its application in bioimaging[J]. Journal of the American Chemical Society, 2007, 129(34): 10322–10323. DOI:10.1021/ja073140i |
| [10] | Zhang Z, Zheng Y, Hang W, Yan X, Zhao Y. Sensitive and selective off-on rhodamine hydrazide fluorescent che-mosensor for hypochlorous acid detection and bioimaging[J]. Talanta, 2011, 85(1): 779–786. DOI:10.1016/j.talanta.2011.04.078 |
| [11] | Zeng X, Dong L, Wu C, Mu L, Xue S F, Tao Z. Highly sensitive chemosensor for Cu(Ⅱ) and Hg(Ⅱ) based on the tripodal rhodamine receptor[J]. Sensors and Actuators B:Chemical, 2009, 141(2): 506–510. DOI:10.1016/j.snb.2009.07.013 |
| [12] | Thomas R, Kazumi S. Detection of nitric oxide and nitrite by using a Rhodamine-type fluorescent indicator[J]. Analytical Communications, 1998, 35(6): 195–197. DOI:10.1039/a802897d |
| [13] |
刘建芳, 侯艳宁, 刘会臣. 柱前衍生-电化学检测HPLC法测定大鼠脑内的谷氨酸和γ-氨基丁酸[J]. 解放军药学学报, 2000, 16(6): 299–302.
Liu J F, Hou Y N, Liu H C. Determination of glutamic and γ-aminobutyric acid in rat brain by HPLC with pre-column derivation and electrochemical detection[J]. Pharmaceutical Journal of Chinese People's Liberation Army, 2000, 16(6): 299–302. |
| [14] |
付彩霞. 氨基酸在溶液中存在形式与pH值的关系[J]. 高师理科学刊, 2010, 30(4): 73–76.
Fu C X. The relationship between the form of amino acid in solution and pH value[J]. Journal of Science of Teachers' Collegeand University, 2010, 30(4): 73–76. |




