2. 贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002;
3. 贵州医科大学 天然产物化学重点实验室, 贵州 贵阳 550002;
4. 黔南民族医学高等专科学校附属医院, 贵州 都匀 558000
2. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550002, Guizhou, P. R. China;
3. The Key Laboratory of Chemistry for Natural Products of Guizhou Medical university, Guiyang 550002, Guizhou, P. R. China;
4. Affiliated Hospital of Qiannan Medical College for Nationality, Duyun 558000, Guizhou, P. R. China
MicroRNA(miRNA)是近年来发现的一类长度为18~24个核苷酸的一类小的内源性功能非编码RNA。参与调控不同肿瘤细胞增殖、分化和凋亡等生命活动过程[1-3]。miRNA-21已经被认定为在多种癌症中过表达的miRNA,能够增加K562细胞迁移和减少细胞凋亡,而miRNA-21的反义寡核苷酸链能够抑制K562细胞迁移,促进K562细胞凋亡,抑制细胞生长[4]。因此,miRNA-21在白血病的发生发展过程中起着重要作用,可作为该疾病潜在的检测标志物[5],早期检测白血病细胞内miRNA-21的含量对癌症的诊断具有重大理论和临床应用价值。尽管Northern Blot法、qRT-PCR技术、微阵列芯片技术等方法已用于miRNA的检测[6],然而由于miRNA在肿瘤细胞内含量低、种类多样,以及这些检测方法在操作过程的复杂性、灵敏度、特异性等方面的限制,还远远不能满足miRNA生物功能研究的需要,特别是在不同肿瘤细胞的原位检测中受到限制[7, 8]。
氧化石墨烯(Graphene Oxide,GO)因具有独特的核酸吸附性能、高效且通用的荧光猝灭性质,以及较低的生物毒性,能改进检测灵敏度、降低检测成本、增大信噪比、进行原位miRNA检测等[9]。碳点(Carbon Dots, CD)作为环境友好、无毒的纳米荧光团之一,具有如下显著特点:发光性能稳定、发光范围可调、易表面修饰、生物毒性低、制备成本低、水溶性好以及生物相容性好等优势,目前已用于生物传感、细胞成像、诊疗等领域[10-21]。本文以碳点为荧光团,将单链DNA连接到碳点表面,制备出核酸功能化的碳点(CD-DNA),并与GO组装成CD-DNA/GO荧光探针用于miRNA-21检测(图 1),CD与GO之间产生长程荧光共振能量转移(long-range resonance energy transfer, LrRET)过程[22],碳点荧光猝灭。当靶标分子miRNA-21存在时,miRNA-21与单链DNA杂交,CD从GO表面分离,荧光共振能量转移被打断,碳点荧光恢复,通过荧光“开”方式检测miRNA-21,该探针并成功应用于血癌K562细胞中原位成像。

|
图 1 CD-DNA/GO探针检测miRNA-21原理示意图 Fig.1 Scheme of CD-DNA/GO probe to detection miRNA-21 |
柠檬酸(CA,99.99%,百灵威科技公司),尿素(urea,99.99%,南京化学试剂有限公司),氯乙酸钠(分析纯,Alfa公司),氧化石墨烯(GO,4 mg/mL,Sigma-Aldrich),小牛胸腺DNA(ctDNA,生物级,Sigma-Aldrich),牛血清白蛋白(BSA,98%,Sigma-Aldrich),其他试剂均为分析纯。
本实验中核酸序列由上海Invitrogen生物公司合成提供,氨基修饰的核酸(DNA)序列为:5’-NH2-C12-TTTCAACATCAGTCTGATAAGCTAT-3’,氨基修饰的任意核酸序(DNA0)列为:5’-NH2-C12-TTCTAAATCGCTATGGTCGC-3’,miRNA-21序列为:5’-UAGCUUAUCAGACUGAUGUUGA-3’,miRNA-155序列为:5’-UUAAUGCUAAUCGUGAUAGGGGU-3’,miRNA-10b序列为:5’-UACCCUGUAGAACCGAAUUUGUG-3’,miRNA-373序列为:5’-ACUCAAAAUGGGGGCGCUUUCC-3’。
PHI 5000型X射线光电子能谱(XPS), 日本ULVAC-PHI公司;Hitachi F-7000荧光光谱仪, 日本日立公司;Hitachi U-4100紫外-可见光谱仪, 日本日立公司;JEM-2100透射电子显微镜, 日本电子株式会社;Nicolet 5700型傅立叶红外光谱仪, 德国Thermo公司;细胞荧光成像采用激光共聚焦显微镜(Leica TCS SP8)成像系统。
1.2 核酸功能化碳点的制备将0.26 g柠檬酸和0.57 g尿素溶于10 mL的超纯水中,在700 W的微波炉中反应3 min,得到黑色固体的粗碳点,按照文献[23]方法制备出富含羧基的碳点并连接核酸,取40 mg再溶解于20 mL的NaOH和氯乙酸钠的溶液中, 水浴3 h,用HCl中和,并用3.5 kDa透析膜透析,制备出富含羧基碳点,用红外和TEM表征。对于核酸功能化碳点,5 mg羧基化的碳点溶于7.5 mL的Tris-HCl缓冲液(0.1 mol·L-1,pH 7.2)中,加入3 mg EDC和4.5 mg NHS反应30 min。再分别加入50 μL核酸(DNA)和任意核酸(DNA0),反应12 h。用透析膜透析纯化,分别制备出核酸功能化的碳点(CD-DNA以及CD-DNA0)备用。
1.3 CD-DNA/GO探针对miRNA-21检测将CD-DNA分散在Tris-HCl缓冲液(10 mmol/L Tris-HCl, 100 mmol/L NaCl, 2 mmol/L KCl, pH 8.0)中,将1 μg/mL的CD-DNA溶液与不同浓度GO溶液混合,构建CD-DNA/GO探针,测量体系的荧光猝灭实验;在荧光恢复实验中,将不同浓度的miRNA-21加入CD-DNA/GO体系中,检测荧光强度变化,计算出miRNA-21浓度与荧光变化的线性范围和检测限。所有荧光测量均室温下进行,激发光波长为330 nm,光电倍增管(PMT)电压为400 V,狭缝宽度为5 nm。
1.4 CD-DNA/GO探针选择性分析在制备的CD-DNA/GO中分别加入常用的miRNA(miRNA-155、miRNA-10b、miRNA-373等)、BSA蛋白、ctDNA,浓度均为1 μmol/L。测量各自的荧光强度。
1.5 CD-DNA/GO探针对细胞内miRNA-21成像将血癌K562细胞培养在24孔板中,细胞浓度为1×104个/mL,加入100 μL 1 mg/mL的CD-DNA/GO探针,培养2 h、8 h后,吸去培养液,用PBS洗去3次,固定,封片,采用共聚焦荧光显微镜成像,激发波长为330 nm。
2 结果与讨论 2.1 核酸功能化碳点的制备柠檬酸和尿素为原料,通过微波法一步合成了碳点,并在其表面进行了羧基化,将制备好的碳点进行XPS表征,如图 2(a)所示,为高分辨率C1s谱,在287.8、286.9、286.0、283.1 eV处有3个峰,分别对应于C=N/C=O、C—O、C—N以及C—C的发射峰,说明碳点表面含有丰富的羧基[24-26]。此外,对碳点的拉曼也进行了表征,如图 2(b)所示,在1580 cm-1处出现最大峰,说明是碳点荧光团的—C=C—伸缩振动,与文献一致[27]。

|
图 2 (a) 碳点的XPS图;(b)碳点的拉曼光谱 Fig.2 (a) The XPS spectra of CDs; (b) Raman spectrum of CDs |
通过NHS/EDC活化反应,将氨基修饰的miRNA-21互补核酸连接到CD上,制备核酸功能化的CD,对其光谱性质和TEM进行了表征。
如图 3(a)所示,随着激发波长增加,荧光发射光谱也会发生红移,在330 nm激发时,发射峰波长为411 nm;350 nm激发时,发射峰波长为423 nm;380 nm激发时,发射峰波长为444 nm。吸收峰为410 nm。随着激发波长增加,荧光强度下降,因此,我们选用330 nm激发出高的荧光强度,用于miRNA-21的检测。

|
图 3 (a)核酸功能化碳点在不同激发波长下的荧光发射光谱以及紫外-吸收光谱;(b)CD-DNA的TEM图,插图为高分辨透射电镜图;(c)CD、CD-DNA、GO、CD-DNA/GO的红外光谱图 Fig.3 (a) The excitation-dependent emission spectra and UV-Vis of CD-DNA, Inset: the CD-DNA photograph under 365 nm UV lamp; (b) The TEM image of CD-DNA, inset: HRTEM image; (c) The FT-IR spectra of CD, CD-DNA, GO and CD-DNA/GO |
由图 3(b)所示的TEM图可知,核酸功能化的碳点具有很好的单分散性,从高分辨电镜可以看出,其粒径约为2.4±0.58 nm,并明显显示出碳晶格结构,晶格条纹间距分别为0.24 nm和0.34 nm两种,与文献相符[28]。
核酸功能化碳点的红外光谱(FTIR)如图 3(c)所示,与单纯的碳点相比,在1054 cm-1处出现了明显的磷酸特征振动峰,说明CD与核酸成功连接。使用硫酸奎宁作为参考标准[29],计算出碳点的荧光量子产率为18.5%,具有较高的量子产率。
2.2 CD-DNA/GO荧光探针构建向所制备的1 μg/mL CD-DNA溶液中加入不同浓度的GO,由于DNA为单链,CD-DNA与GO烯通过“π-π”堆积作用相互吸引,组装形成CD-DNA/GO纳米荧光探针,如图 4(a)所示,由于CD-DNA与GO之间发生长程共振能量转移过程,随着GO浓度的增加,CD-DNA荧光被逐渐猝灭。对GO的浓度与CD-DNA荧光强度作点线图,如图 4(b),当GO的浓度小于40 μg/mL时,CD-DNA的荧光强度呈现强的线性猝灭,R2=0.997;当GO的浓度大于40 μg/mL时,猝灭效率降低;当GO浓度为40 μg/mL时,CD-DNA的荧光强度猝灭到原来的27%。因此,在CD-DNA浓度为1 μg/mL,GO浓度为40 μg/mL时,构建CD-DNA/GO荧光探针,荧光处于“关”状态,为下一步通过荧光“开”方式检测miRNA-21奠定基础。
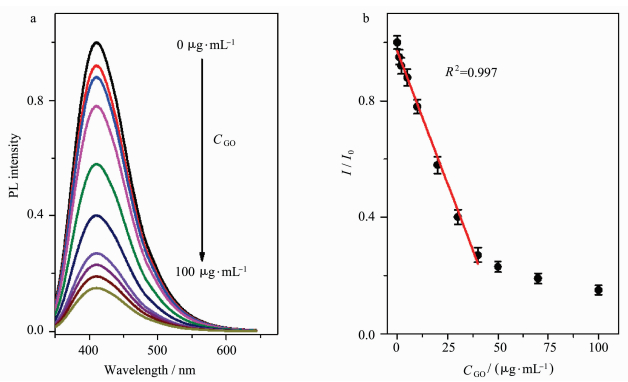
|
图 4 不同浓度的GO猝灭CD-DNA荧光光谱(a)和点线图(b) Fig.4 (a) Evolution of PL spectra of CD-DNA with the GO concentration; (b) relationship between the relative PL intensity (I/I0) and the GO concentration |
我们对所构建的CD-DNA/GO荧光探针进行了红外光谱表征,如图 3(c)所示,CD-DNA与GO组装后,其离心沉淀物在1054 cm-1处也出现了DNA的磷酸的特征振动峰,说明CD-DNA/GO荧光探针构建成功。
2.3 CD-DNA/GO荧光探针用于miRNA-21检测将CD-DNA/GO荧光探针与靶标miRNA-21进行简单共混,实现对miRNA-21的检测。如图 5(a)所示,随着miRNA-21浓度的增加,该荧光探针的荧光强度逐渐增加,这主要是由于miRNA-21存在时,DNA与靶标分子miRNA-21通过碱基配对杂交,形成DNA-RNA双链,打断DNA与GO的“π-π”堆积作用,从GO表面分离,CD与GO之间的长程共振能量转移过程被打断,CD荧光恢复,实现对miRNA-21的检测。

|
图 5 不同浓度的miRNA-21恢复CD-DNA/GO荧光光谱(a)和点线图(b) Fig.5 (a) Evolution of PL spectra of CD-DNA/GO with the miRNA-21 concentration; (b) Relationship between the relative PL intensity (I/I0) and the miRNA-21 concentration |
通过计算相对荧光强度(I/I0)与miRNA-21浓度的变化关系曲线,如图 5(b)所示,计算出CD-DNA/GO纳米荧光探针对miRNA-21的检测限为0.2 nmol/L (3σ),并与miRNA-21浓度在1~500 nmol/L范围有良好的线性关系,R2=0.998,通过荧光“开”方式实现对miRNA-21的检测。
2.4 CD-DNA/GO纳米荧光探针检测miRNA-21的原理证明通过TEM以较直观的方式对CD-DNA/GO纳米荧光探针的miRNA-21检测过程进行了验证。如图 6(a)所示,GO呈现出单层薄片状;而在CD-DNA/GO荧光探针中,图 6(b)所示,GO表面呈现密集的点状,说明CD-DNA都吸附在GO表面,DNA单链与GO通过的“π-π”堆积作用,将CD吸附在GO表面。当miRNA-21存在时,如图 6(c)所示,CD均匀分布在整个视野中,说明CD脱附GO表面,DNA与miRNA-21杂交结合,打断了DNA与GO的“π-π”堆积作用,从而使CD脱附GO表面。

|
图 6 (a) GO、(b)不存在miRNA-21、(c)存在miRNA-21时的CD-DNA/GO体系的TEM图,白色虚线为GO的边缘 Fig.6 The TEM images of (a) GO, (b) CD-DNA/GO and (c) CD-DNA/GO in present of miRNA-21 |
荧光探针的特异性是分析性能的主要指标之一,图 7为对CD-DNA/GO纳米荧光探针的选择性分析,在该探针中加入其它miRNA(如:mi-RNA-155、miRNA-10b、miRNA-373等)、常用蛋白(如BSA)、双链ctDNA。发现只有加入miRNA-21存在时,CD荧光增强,而其他miRNA、蛋白以及双链DNA等生物分子对该荧光探针没有明显响应,说明该探针对miRNA-21具有较好的特异性。

|
图 7 CD-DNA/GO纳米荧光探针选择性分析 Fig.7 Selectivity analysis of CD-DNA/GO fluorescent probe |
白血病是人类癌症发生之一,其癌细胞K562中的miRNA-21含量对癌症的发生起着重要作用,以白血病K562细胞中的miRNA-21进行细胞成像,如图 8(a)所示,CD-DNA0/GO与K562细胞培养8 h作为对照(CD-DNA0为任意核酸序列功能化的碳点),发现K562细胞无荧光。当CD-DNA/GO荧光探针与K562细胞共培养2 h后,K562细胞的荧光出现,且荧光较弱,主要分布在细胞质中,如图 8(b)所示,说明CD-DNA/GO荧光探针进入细胞,对细胞内miRNA-21成像;随着CD-DNA/GO荧光探针与K562细胞共培养时间延长至8 h时,细胞内呈现出较强的荧光,如图 8(c)所示,说明利用该荧光探针可以实现对肿瘤K562细胞成像。

|
图 8 CD-DNA/GO和CD-DNA0/GO纳米荧光探针对K562细胞共聚焦成像,(a) CD-DNA0/GO与K562细胞共培养8 h;CD-DNA/GO纳米荧光探针与K562细胞共培养2 h(b)和8 h(c) Fig.8 Confocal images of K562 cancer cells after incubation with CD-DNA0/GO for 8 h (a), with CD-DNA/GO for 2 h (b) and 8 h (c) |
本研究中成功制备出核酸功能化的碳点(CD-DNA),并与GO组装成CD-DNA/GO荧光探针,实现了对miRNA-21的检测,利用CD与GO之间产生长程荧光共振能量转移机制,碳点荧光猝灭。当靶标分子miRNA-21存在时,miRNA-21与单链DNA杂交,CDs从GO表面分离,荧光共振能量转移被打断,碳点荧光恢复,通过荧光“开”方式特异性检测miRNA-21。该探针成功应用于血癌K562细胞中miRNA-21的原位成像,为血癌的原位诊断和治疗提供了研究依据。
| [1] | Ventura A, Jacks T. MicroRNAs and cancer:short RNAs go a long way[J]. Cell, 2009, 136(4): 586–591. DOI:10.1016/j.cell.2009.02.005 |
| [2] | Kundu S T, Byers L A, Peng D H, Roybal J D, Diao L, Wang J, Gibbons D L. The miR-200 family and the miR-183 similar to 96 similar to 182 cluster target Foxf2 to inhibit invasion and metastasis in lung cancers[J]. Oncogene, 2016, 35(2): 173–186. DOI:10.1038/onc.2015.71 |
| [3] | Telonis A G, Loher P, Yi J. Beyond the one-locus-one-miRNA paradigm:microRNA isoforms enable deeper insights into breast cancer heterogeneity[J]. Nucleic Acids Research, 2015, 43(19): 9158–9175. DOI:10.1093/nar/gkv922 |
| [4] | Hu H, Li Y, Gu J. Antisense oligonucleotide against miR-21 inhibits migration and induces apoptosis in leukemic K562 cells[J]. Leukemia and Lymphoma, 2010, 51(4): 694. DOI:10.3109/10428191003596835 |
| [5] | Li M, Li J, Ding X, He M, Cheng S Y. MicroRNA and Cancer[J]. The AAPS Journal, 2010, 12(3): 309–317. DOI:10.1208/s12248-010-9194-0 |
| [6] | Shen Y, Tian F, Chen Z. Amplification-based method for microRNA detection[J]. Biosensors Bioelectronics, 2015, 71: 322–331. DOI:10.1016/j.bios.2015.04.057 |
| [7] | Choi C K, Li J, Wei K, Xu Y J, Ho L W, Zhu M, To K K, Choi C H, Bian L. A gold@polydopamine core-shell nanoprobe for long-term intracellular detection of microRNAs in differentiating stem cells[J]. Journal American Chemical Society, 2015, 137(23): 7337–7346. DOI:10.1021/jacs.5b01457 |
| [8] |
成永强, 李正平, 王愈聪, 范永山. MicroRNA分析方法进展[J]. 化学进展, 2010, 22(8): 1509–1517.
Chen Y Q, Li Z P, Wang Y C, Fan Y S. MicroRNA detection[J]. Progress in Chemistry, 2010, 22(8): 1509–1517. |
| [9] | Ryoo S, Lee J, Yeo J. Quantitative and multiplexed microRNA sensing in living cells based on peptide nucleic acid and nano graphene oxide (PANGO)[J]. ACS Nano, 2013, 7(7): 5882–5891. DOI:10.1021/nn401183s |
| [10] | Ding C, Zhu A, Tian Y. Functional surface engineering of C-dots for fluorescent biosensing and in vivo bioimaging[J]. Accounts of Chemical Research, 2014, 47(1): 20–30. DOI:10.1021/ar400023s |
| [11] |
侯昌顺, 葛介超. 多色荧光碳点的制备新进展[J]. 影像科学与光化学, 2017, 35(1): 1–14.
Hou C S, Ge J C. New progress in preparation of multicolor carbon dots[J]. Imaging Science and Photochemistry, 2017, 35(1): 1–14. DOI:10.7517/j.issn.1674-0475.2017.01.001 |
| [12] |
唐志姣, 李攻科, 胡玉玲. 氮掺杂碳点的制备及在定量分析中的应用[J]. 化学进展, 2016, 28(10): 1455–1461.
Tang Z J, Li G K, Hu Y L. Advances in preparation and applications in quantitative analysis of nitrogen-doped carbon dots[J]. Progress in Chemistry, 2016, 28(10): 1455–1461. |
| [13] |
王胜达, 袁楠, 朱志峰, 蒋阳. 荧光碳点的合成、性质和应用[J]. 影像科学与光化学, 2016, 34(3): 203–218.
Wang S D, Yuan N, Zhu Z F, Jiang Y. Synthesis, properties and applications of the fluorescent carbon dots[J]. Imaging Science and Photochemistry, 2016, 34(3): 203–218. DOI:10.7517/j.issn.1674-0475.2016.03.203 |
| [14] |
邓亚峰, 周奕华, 钱俊, 罗妍, 吴丽辉. 基于上转换发光的碳量子点制备及应用研究[J]. 影像科学与光化学, 2017, 35(6): 884–893.
Deng Y F, Zhou Y H, Qian J, Luo Y, Wu L H. Preparation and application of carbon quantum dots based on up conversion photoluminescence[J]. Imaging Science and Photochemistry, 2017, 35(6): 884–893. DOI:10.7517/j.issn.1674-0475.2017.05.010 |
| [15] |
李欣彤, 吴晶, 张德蒙, 谭明乾, 马小军. 新型水溶性多色荧光碳点的制备及细胞成像研究[J]. 分析测试学报, 2014, 33(4): 380–386.
Li X T, Wu J, Zhang D M, Tan M Q, Ma X J. Preparation of novel water soluble multicolor carbon dots for cell imaging[J]. Journal of Instrumental Analysis, 2014, 33(4): 380–386. |
| [16] |
木合塔尔·吐尔洪, 徐阳, 尹学博. 碳点的研究进展[J]. 分析化学, 2017, 45(1): 139–150.
Mhetaer T, Xu Y, Yin X B. Review on carbon dots and their applications[J]. Chinses Journal of Analytical Chemistry, 2017, 45(1): 139–150. DOI:10.11895/j.issn.0253-3820.160295 |
| [17] | Qu D, Miao X, Wang X T, Nie C, Li Y X, Luo L, Sun Z C. Se & N co-doped carbon dots for high-performance fluorescence imaging agent of angiography[J]. Journal of Materials Chemistry B, 2017, 5(25): 4988–4992. DOI:10.1039/C7TB00875A |
| [18] | Miao X, Yan X L, Du D, Li D B, Tao F F, Su Z C. Red emissive sulfur, nitrogen codoped carbon dots and their application in ion detection and theraonostics[J]. ACS Applied Material & Interfaces, 2017, 9(22): 18549–18556. |
| [19] | Zheng M, Xie Z G, Qu D, Li D, Du P, Jing X B, Sun Z C. On-off-on fluorescent carbon dot nanosensor for recognition of chromium(Ⅵ) and ascorbic acid based on the inner filter effect[J]. ACS Applied Materials & Interfaces, 2013, 5(24): 13242–1324. |
| [20] |
颜范勇, 邹宇, 王猛, 代林枫, 周旭光, 陈莉. 荧光碳点的制备及应用[J]. 化学进展, 2014, 26(1): 61–74.
Yan F Y, Zhou Y, Wang M, Dai L F, Zhou X G, Chen L. Synthesis and application of the fluorescent carbon dots[J]. Progress in Chemistry, 2014, 26(1): 61–74. |
| [21] |
赵薇, 张志凌, 庞代文. 量子点荧光标记技术在生物医学领域的应用[J]. 化学传感器, 2008, 28(1): 8–14.
Zhao W, Zhang Z L, Pang D W. Application of quantum dots as fluorescent labels in medicine and biology[J]. Chemical Sensors, 2008, 28(1): 8–14. |
| [22] | Hu X Y, Liu Y Q, Qu X J, Sun Q J. A quantum dot-labelled aptamer/graphene oxide system for the construction of a half-adder and half-subtractor with high resettability[J]. Chemical Communications, 2017, 53(81): 11181–11184. DOI:10.1039/C7CC05279K |
| [23] | Gui R J, Jin H, Wang Z H, Zhang F F, Xia J F, Yang M, Bi S, Xia Y Z. Room-temperature phosphorescence logic gates developed from nucleic acid functionalized carbon dots and graphene oxide[J]. Nanoscale, 2015, 7(18): 8289–8293. DOI:10.1039/C4NR07620F |
| [24] | Schneider J, RecKmeier C J, Xiong Y, Seckendorff M, Susha A S, Kasak P, Rogach A L. Molecular fluorescence in citric acid-based carbon dots[J]. The Journal of Physical Chemistry C, 2017, 121(3): 2014–2022. DOI:10.1021/acs.jpcc.6b12519 |
| [25] | Bankoti K, Rameshbabu A P, Datta S, Das B, Mitra A, Dhara S. Onion derived carbon nanodots for live cell imaging and accelerated skin wound healing[J]. Journal of Materials Chemistry B, 2017, 5(32): 6579–6592. DOI:10.1039/C7TB00869D |
| [26] | Sharma V, Tiwari P, Mobin S M. Sustainable carbon-dots:recent advances in green carbon dots for sensing and bioimaging[J]. Journal of Materials Chemistry B, 2017, 5(45): 8904–8924. DOI:10.1039/C7TB02484C |
| [27] | Das A, Gude V, Roy D, Chatterjee T, De C K, Mandal P K. On the molecular origin of photoluminescence of nonblinking carbon dot[J]. The Journal of Physical Chemistry C, 2017, 121(17): 9634–9641. DOI:10.1021/acs.jpcc.7b02433 |
| [28] | Miao X, Qu D, Yang D X, Nie B, Zhao Y K, Fan H Y, Sun Z C. Synthesis of carbon dots with multiple color emission by controlled graphitization and surface functionalization[J]. Advanced Materials, 2018, 30(1): 1704740. DOI:10.1002/adma.201704740 |
| [29] | Ma J, Guo B L, Cao X T, Lin Y P, Yao B X, Li F M, Weng W, Huang L Z. One-pot fabrication of hollow cross-linked fluorescent carbon nitride nanoparticles and their application in the detection of mercuric ions[J]. Talanta, 2015, 143: 205–211. DOI:10.1016/j.talanta.2015.05.063 |




