健康、疾病等与人类生命相关的问题是伴随人类发展过程中不可避免,并且困扰着人们生活的主题。随着社会的发展和科学技术的不断进步,特别是医疗卫生事业的发展,有些疾病,如天花、霍乱已销声匿迹,有些疾病,如败血病、结核病已得到控制。但也有一些疾病,如恶性肿瘤和心脑血管疾病, 作为人类健康的杀手,它们是导致人类死亡率最高的两类疾病。特别是恶性肿瘤在当今医学界已成为除心脑血管疾病以外严重困扰人类的一大难题,被称为“21世纪的瘟疫”。而对肿瘤的治疗,早期的诊断非常重要,它是提高患者治愈率和病人生存率的关键所在。
分子成像技术在疾病的早期诊断中发挥着非常重要的作用。分子成像技术是指利用一定的体外成像检测装置在细胞和分子层次上对活体动物和人体的生物学过程进行的成像。分子成像基本过程为:分子影像探针→进入活体组织细胞→分子探针标记物与靶分子进行作用→发出检测信号→影像装置采集检测信号→计算机处理并成像→显示图像。尽快发展一种高、精、尖的分子成像技术以利于肿瘤的早期诊断,是现代医学研究中最重要的目标之一。
2 医学影像中的分子成像技术分子成像可以利用成像分子探针和信号来定性或定量检测生物体内生理、病理变化,这使医学成像技术发展成为在生命科学和治疗诊断学中的一种重要工具。无论在基础科学研究还是在临床医学方面都具有重大的研究意义,并且得到了快速发展。
目前,分子成像技术[1-4]主要包括超声成像(ultrasound)、X-射线计算机断层成像(X-ray computed tomography)、光学成像(optical imaging)、核磁共振成像(magnetic resonance imaging)、核医学成像(nuclear medicine imaging)。其中,核医学成像技术包括单光子发射断层成像(single-photon emission computed tomography:SPECT)和正电子发射断层成像(positron emission tomography: PET)。这几种分子影像技术在成像灵敏度、空间和时间分辨率等性能方面各有自己的优缺点。
图 1是几种典型的影像仪器并用实验鼠进行成像的例子[5, 6]。A图为正电子发射断层成像的装置及小动物成像,B图为单光子发射断层成像装置及其成像,C图为光学成像设备及小动物成像,D图为核磁共振成像装置及小动物成像的应用,E图为CT装置及成像,F图为超声装置及小动物成像图。图中均以活体动物即实验鼠作为研究对象。以下将分类进行介绍。
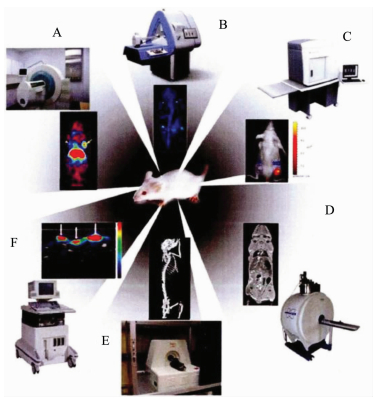
|
图 1 分子成像设备及其成像 Fig.1 The instrument and its molecular imaging |
超声作为常见的一种成像技术,以超声回波作为检测信号,图像信号反映的是人体组织声学特性。首先将特异性配体与超声造影剂表面相连,通过体内血液循环并特异性地积聚于人体组织器官,利用超声声束扫描人体,通过对反射信号的接收、处理,观察组织在分子或细胞水平的特异性显像,获得体内器官的图像,反映病变组织在分子基础上的变化。超声成像方法常用于判断某些脏器器官的位置、大小、形态,确定病灶部位的范围和物理化学性质,提供一些组织器官的解剖图[7-11]。超声成像技术现已广泛应用于临床诊断,如在眼科、妇产科及心血管系统、消化系统、泌尿系统等。
目前,超声造影剂主要有3种:脂类造影剂、高分子聚合物微泡造影剂、液态氟碳纳米颗粒。利用超声造影剂进行成像时,设备相对比较便宜,经济实惠,方便快捷,一般医院都有超声设备。超声诊断可获得器官的任意断面图像,提供实时检测图像和观察某些运动器官的活动情况,成像速度快,诊断准确及时,无痛苦,几乎无危险,属于无损伤性检查。同时,无毒害、无污染。因此,超声成像技术在临床上应用已非常普及,是医学影像中不可缺少的组成部分,但其缺点是图像的对比度和分辨率不高。
2.2 医学影像中的计算机断层扫描成像技术计算机断层扫描成像技术(CT)是基于人体不同的器官或组织具有不同的密度与厚度,通过X射线照射人体,不同的组织器官对X射线有不同程度的吸收作用,从而形成人体不同组织或器官的影像对比灰度分布图,达到对病灶产生的位置、形状、大小和状态等确定并判断病情。X射线对人体检查的某些器官进行一定深度的扫描,通过探测器接收扫描后的X射线,首先将其转变为光信号,光信号通过光电转换器或光电倍增管转变为电信号,再经数字转换器将电信号转为数字,经过计算机处理得到最终结果。
基于成像目标的理化特性,传统CT成像都反映的是疾病的最终状态,无法反映出疾病早期的发生、疾病中期的发展和疾病的状态和性质。随着具有更高灵敏度和分辨率的CT的出现,这项传统技术也得到广泛应用,但主要用于骨科和肿瘤的诊断。CT采用X射线,X射线对人体有一定的毒害性。计算机断层扫描成像技术提供的解剖学信息分辨率高,但灵敏度低。CT单独作为一种分子影像仪器并不常用,经常和其它仪器软件联用,如CT和PET、SPECT联用,可以起到互补的作用[12-19]。
含碘的化合物常用作超声成像造影剂,但碘具有一定的毒性。目前,在科研领域,纳米金常作为超声成像造影剂的首选材料。纳米金具有许多优良的特性,如易化学修饰、生物兼容性好、低毒性、独特的表面等离子共振特点,还具有分散性好和稳定性高的特点,以及高的X射线吸收系数和被动肿瘤靶向性。纳米金易合成、表面容易修饰,可将生物靶向分子、荧光分子以及其他功能分子修饰到纳米金表面,弥补了传统显影剂缺陷。
2.3 医学影像中的光学成像技术活体动物光学成像技术主要有荧光成像和生物成像等[20]。此外,还出现了一些基于化学发光原理的活体成像研究。生物发光与荧光两者都存在荧光物质的电子从激发态跃迁到基态而产生光能的过程,但两者的主要区别在于电子是如何达到激发态的:在生物发光中,由化学反应的热能提供激发电子的能量,而在荧光过程中,激发电子的能量主要来自于激发光如可见光、紫外线、红外线等的电磁辐射。
近年来,由于光电子和光学测量技术的迅速发展,荧光成像技术开始用于小动物成像[21-26]。荧光成像用于活体分析时干扰比较大,主要原因是生物体很多物质受到激发光激发都会产生荧光,如动物的各种组织、皮肤、毛发、脏器器官等。特别是被标记的探针分子在组织内部成像时需要激发光的能量较高,这样产生的非特异性荧光很强,这些非特异性荧光产生的背景噪音会对成像产生非常严重的干扰。尽管很多学者试图采用新的方法扣除背景光,减少干扰,但是由于荧光特性的限制,技术手段上很难完全消除背景干扰,因而荧光成像的灵敏度不够高。此外,活体分析时需要激发光穿过脏器器官到达靶点,发射光在动物体内穿透的距离较长,并且信号取决于激发光的强度、靶点的位置、发光体的数量、光线被组织吸收及散射等因素,使得荧光强度很难定量。但是,荧光成像也具有一定的优点,如方便、便宜、直观。
近红外荧光成像技术因穿透组织能力相对较强,近年来在活体成像方面有着广泛的应用,主要用于对肿瘤的早期检测。由于生物体组织中的水和血细胞在近红外范围(650~900 nm)内有较低的吸收系数,因此近红外探针在近红外波长范围内可以获得较高的信噪比,得到高灵敏度的成像,且对人体损害较小。贵金属纳米材料如纳米金、纳米花等,其等离子共振效应可使材料的吸收峰由紫外光区红移至近红外光区。纳米金的近红外特性使之成为理想的材料用于光热治疗、医学成像。
传统光学成像在动物组织脏器器官内部存在一定的光散射,而多功能成像技术如光声成像同时具有光学成像对比度高和选择性,以及超声成像穿透深度强的优点。用脉冲激光照射到动物脏器器官时,脏器器官将产生超声信号,这种由光激发而产生的超声信号为光声信号,光声信号携带了组织的光吸收性质,通过光声信号重建可以得到组织的光吸收分布图。光声成像从原理上克服了光散射的影响,可得到更高分辨率和对比度图像,实现50 mm的活体内组织成像,美国华盛顿大学Wang L V小组是目前该领域有影响力的研究团队之一[27]。合成设计优良的造影剂将成为光声成像的重点。利用纳米粒子造影剂,光声成像有望在对组织成像的同时进行药物治疗。
光学相干断层扫描技术是近些年来迅速发展起来的一种成像技术,利用弱相干光干涉原理,检测动物脏器器官不同深度对入射弱相干光的背向反射或几次散射信号,通过扫描得到生物组织脏器器官二维或三维图像。它主要用于眼科、肿瘤科以及工业领域。光学相干断层扫描在上世纪90年代发明,目前已有3~5代,最先进的仪器是美国OPTOVUE公司生产的。
生物发光主要利用荧光素酶基因整合到细胞染色体DNA上,当通过腹腔或者静脉注射给予底物荧光素,几分钟内便可产生发光现象,利用灵敏的光学检测仪器将光信号进行转化,便可获知活体生物体内细胞和基因的行为。但光学成像光的穿透力非常有限,其穿透深度只能达到表皮数亳米至几厘米,所以目前光学成像主要应用于小动物模型的基础研究,临床应用还有一定的限制,主要在眼睛和皮肤[28]。但光学成像有一定的优点,如成本低,如果可以和其他技术如MR和PET联用,预计将在临床中有着广泛的应用前景。生物发光成像和荧光成像相比较,具有一定的优点,如不需要激发光进行激发、高的灵敏度、高的信噪比、计算方便等,而荧光成像的优点是方便、直观、标记靶点比较多。
2.4 医学影像中的核磁共振成像技术核磁共振成像(简称MRI),又称自旋成像、磁共振成像、磁振造影,由Lauterbur在1973年提出[29]。核磁共振成像是利用生物组织中的氢原子核在磁场内与磁场外发生共振而产生影像的一种成像技术。在磁场的作用下,一些具有磁性的原子能够产生不同的能级,如果外加一个能量(即射频磁场),且这个能量恰能等于相邻2个能级能量差,则原子吸收能量产生跃迁(即产生共振),从低能级跃迁到高能级,能级跃迁能量的数量级为射频磁场的范围。核磁共振分为共振吸收和共振发射,总称“核磁共振”。一个磁共振成像扫描人类大脑,由头顶开始,一直到基部,就可以获得一个连续的动画图像,然后对图像进行对比分析,就可以确定病灶。核磁共振成像中的“核”一般指的是氢原子核,因为人体中的水大约占了70%,MRI即依赖水中的氢原子,MRI成像主要通过人体中的氢原子核成像。由于人们一听到“核”,容易使患者产生恐惧心理,增加病人心理负担,通常将这门技术又简称为磁共振成像。
现阶段,核磁共振成像主要应用于基础研究、基因表达与基因治疗成像、评价肿瘤的血管生成、细胞调亡、活体细胞的功能性和显微成像等方面,可以大大推动人类某些疾病的早期诊断、治疗方案的确定以及治疗的监测[30-37]。传统MRI显影剂是二乙三胺五乙酸钆,一种钆(Gd)与二乙烯三胺五乙酸(DTPA)的螯合物,但该螯合物解离后具有一定的毒性。超顺磁性四氧化三铁(Fe3O4)纳米颗粒(SPIONs)常作为MRI显影剂的首选,其磁性强、易分离、合成简单、在动物体内无毒害,因此得到了科研工作者的广泛青睐。此外,含钆的纳米材料也用于MRI成像探究。复旦大学李富有教授合成了一种Gd掺杂的集光学、MRI、PET具有3种成像功能的纳米探针,用于小动物活体成像[38]。MRI作为分子影像的一个非常重要的工具,它的优点在于既能显示形态学结构,又能展现原子核水平上的生化信息,还能显示某些脏器器官的功能状况,并且安全无电离福射伤害,具有高的空间分辨率。但相比于其它分子影像仪器,MRI的不足在于其灵敏度相对较低,因此所需的探针计量比较大,故可能会产生干扰并改变体内的代谢。
2.5 医学影像中的核医学成像技术核医学(RNI)成像又称为放射性核素成像[39],主要包括正电子发射(PET)成像和单光子发射计算机断层(SEPCT)成像[40]。其检测的信号是摄入人体内的放射性核素衰变时所放出的射线,图像信号可反映放射性核素在活体内的范围、浓度分布,并显示组织和器官形态学信息和功能信息等。
PET常用的正电子核素有11C、13N、15O、18F,表 1列出了几种常见的正电子核素。然而碳元素的半衰期较短,约为20.4 min,11C标记药物具有以下优点:不影响结构及其功效、成本较低,并可在短期内重复进行实验。用13N标记氨基酸就成为人们研究氨基酸在生物体内的代谢过程、生理功能与病理等的一个非常可信而有利的工具。然而13N半衰期更短,只有9.96 min。氧元素是组成一切生物体的最基本元素,也是维持生命活动必不可缺的基本物质,但由于物理半衰期比前两种更短,O只有1225 s,限制了它在PET中的应用。
| 表 1 常用发射正电子的放射性核素的物理特性 Table 1 The physical properties of commonly positron radionuclide |
18F是PET中最常用的放射性核素[41]。氟是卤族元素,具有强的氧化性,极易获得一个电子形成稳定的18F离子。以18O核反应生成18F离子最常用,18F可以在医院通过小型回旋加速器生产,通过回旋加速器轰击18O[H2O],最终得到18F离子,无载体,因而可获得高比活度的PET药物。目前,18F作为PET核素已经广泛应用于生物、医学等领域[42-45]。
PET常被用于检测体内代谢动力学过程有关的功能信息。PET成像时,组织或器官代谢率高的,在PET上呈显著的亮信号,代谢率低的组织在PET图像上呈低暗信号或者没有信号。通过PET成像,可以从分子水平上反映人体组织或器官的生理、病理、生化及代谢等状况,尤其适合生理功能方面的研究,但是解剖结构图像不太清楚,PET/CT为了解决这个问题应运而生。
核医学成像利用放射性核素能从分子水平上认识疾病,并阐明靶器官或组织的血流情况、受体密度与基因的异常表达、生化代谢活性与细胞信息等机制。因此,核医学能为疾病进行早期诊断、有效治疗与基础研究提供分子水平上的信息。核医学成像作为一种功能性成像,已成为当今世界医学领域研究的前沿、热点课题之一。
3 几种成像技术的对比分子影像技术具有非常广阔的应用前景,与其它影像方法相比具有以下优点:具有很高的灵敏度、可定量、无创伤、空间分辨率高等优点。表 2列举了几种常见影像手段的性能和特征比较[46],这几种分子影像技术各有优缺点,如超声成像花费低、组织穿透性高、可进行实时监测,但分辨率较低;CT成像具有很高的灵敏度,组织深度无限制,但有辐射伤害、花费高、不能进行定量;光学成像的灵敏度高、可实现多色标记,但组织穿透性较低、空间分辨率非常低;MRI分辨率较高、组织深度无限制,但灵敏度较低、花费较高、成像时间较长;PET具有很高的灵敏度、无组织深度限制、能进行定性定量,但核辐射伤害比较大,且设备昂贵、使用费较高。
| 表 2 各种分子影像技术特性比较 Table 2 The characteristics of various molecular imaging technology |
近年来,分子影像技术发展迅速,趋于多种分子影像技术进行融合,将多种成像模式配套使用,可以取长补短,发挥各自的成像优势。同时,分子影像学的发展除了先进的成像设备仪器外,分子影像学的核心是发展新型而高效的成像探针。分子探针、信号放大、高灵敏度探测是分子影像技术的关键,其中分子探针是进行成像时信号放大和高灵敏度检测的基础。随着纳米技术的发展,以纳米材料为基础建立的纳米影像探针有望在分子成像方面取得巨大进展。
| [1] | Arbeille P, Eder V, Casset D. Rea-l time 3D ultrasound acquisition and display for cardiac volume and ejection fraction evaluation[J]. Ultrasound in Medicine & Biology, 2000, 26(3): 201–208. |
| [2] | Cai W B, Chen X Y. Nanoplatforms for targeted molecular imaging in living subjects[J]. Small, 2007, 3(11): 1840–1854. DOI:10.1002/(ISSN)1613-6829 |
| [3] | Wang Y Y, Liu X J, Deng G Y. Multifunctional PS@CS@Au-Fe3O4-FA nanocomposites for CT, MR and fluorescence imaging guided targeted-photothermal therapy of cancer cells[J]. Journal of Materials Chemistry B, 2017, 5(22): 4221–4232. DOI:10.1039/C7TB00642J |
| [4] | Hou X M, Wang X D, Liu R. Facile synthesis of multifunctional Fe3O4@SiO2@Au magneto-plasmonic nanoparticles for MR/CT dual imaging and photothermal therapy[J]. RSC Advance, 2017, 7(31): 18844–18850. DOI:10.1039/C7RA00925A |
| [5] | Massoud T F, Gambhir S S. Molecular imaging in living subjects:seeing fundamental biological processes in a new light[J]. Genes Development, 2003, 17(5): 545–580. DOI:10.1101/gad.1047403 |
| [6] | Blankenberg F G, Strauss H W. Nuclear medicine applications in molecular imaging[J]. Magnetic Resonance Imaging, 2002, 16(4): 352–361. DOI:10.1002/(ISSN)1522-2586 |
| [7] | Sharahi H J, Shekhawat G, Dravid V. Contrast mechanisms on nanoscale subsurface imaging in ultrasonic AFM:scattering of ultrasonic waves and contact stiffness of the tip-sample[J]. Nanoscale, 2017, 9(6): 2330–2339. DOI:10.1039/C6NR09124E |
| [8] | Hettiarachchi K, Talu E, Longo M L. On-chip generation of microbubbles as a practical technology for manufacturing contrast agents for ultrasonic imaging[J]. Lab on a Chip, 2007, 7(4): 463–468. DOI:10.1039/b701481n |
| [9] | Zhang S Y, Han Y Q, Zhu X G. Feasibility of using ultrasonic nakagami imaging for monitoring microwave-induced thermal lesion inex vivo porcine liver[J]. Ultrasound in Medicine & Biology, 2017, 43(2): 482–493. |
| [10] | Shung K K. High frequency ultrasonic imaging[J]. Journal of Medical Ultrasound, 2009, 17(1): 25–30. DOI:10.1016/S0929-6441(09)60012-6 |
| [11] | Samimi K, Whit K J, Brace C L. Monitoring microwave ablation of ex vivo bovine liver using ultrasonic attenuation imaging[J]. Uutrasound in Medicine & Biology, 2017, 43(7): 1441–1451. |
| [12] | Sasidharan S, Bahadur D, Srivastava R. Albumin stabilized gold nanostars:a biocompatible nanoplatform for SERS, CT imaging and photothermal therapy of cancer[J]. RSC Advance, 2016, 6(87): 84025–84034. DOI:10.1039/C6RA11405A |
| [13] | Doerner J, Hauger M, Hickethier T. Image quality evaluation of dual-layer spectral detector CT of the chest and comparison with conventional CT imaging[J]. European Journal of Radiology, 2017, 93: 52–58. DOI:10.1016/j.ejrad.2017.05.016 |
| [14] | Zhang Y X, Zhang H, Wang Y K. Hydrophilic graphene oxide/bismuth selenide nanocomposites for CT imaging, photoacoustic imaging, and photothermal therapy[J]. Journal of Materials Chemistry B, 2017, 5(9): 1846–1855. DOI:10.1039/C6TB02137A |
| [15] | Xiong Z J, Wang Y, Zhu J Y. Dendrimers meet zwitterions:development of a unique antifouling nanoplatform for enhanced blood pool, lymph node and tumor CT imaging[J]. Nanoscale, 2017, 9(34): 12295–12301. DOI:10.1039/C7NR03940A |
| [16] | Wang Y Y, Liu X J, Deng G Y. Multifunctional PS@CS@Au-Fe3O4-FA nanocomposites for CT, MR and fluorescence imaging guided targeted-photothermal therapy of cancer cells[J]. Journal of Materials Chemistry B, 2017, 5(22): 4221–4232. DOI:10.1039/C7TB00642J |
| [17] | Elmenoufy A H, Tang Y A, Hu J. A novel deep photodynamic therapy modality combined with CT imaging established via X-ray stimulated silica-modified lanthanide scintillating nanoparticles[J]. Chemical Communication, 2015, 51(61): 12247–12250. DOI:10.1039/C5CC04135J |
| [18] | Shi H T, Niu M, Tan L F. A smart all-in-one theranostic platform for CT imaging guided tumor microwave thermotherapy based on IL@ZrO2 nanoparticles[J]. Chemical Science, 2015, 6(8): 5016–5026. DOI:10.1039/C5SC00781J |
| [19] | Peng C, Qin J B, Zhou B Q. Targeted tumor CT imaging using folic acid-modified PEGylated dendrimer-entrapped gold nanoparticles[J]. Polymer Chemistry, 2013, 4(16): 4412–4424. DOI:10.1039/c3py00521f |
| [20] | Greer L F, Szalay A A. Imaging of light emiss ion from the express ion of luciferases in living cells and organisms:a review[J]. Luminescence, 2002, 17(1): 43–74. DOI:10.1002/(ISSN)1522-7243 |
| [21] | Tseng J C, Levin B, Hurtado A. Systemic tumor targeting and killing by sindbis viral vectors[J]. Natture Biotechno-logy, 2004, 22(1): 70–77. DOI:10.1038/nbt917 |
| [22] | Majlesara A, Golriz M, Hafezi M. Indocyanine green fluorescence imaging in hepatobiliary surgery[J]. Photodiagnosis and Photodynamic Therapy, 2017, 17(5): 208–215. |
| [23] | Etrych T, Lucas H, Olga J. Fluorescence optical imaging in anticancer drug delivery[J]. Journal of Controlled Release, 2016, 226(28): 168–181. |
| [24] | Wei X J, Li M M, Hu P. Programmable binary chimera aptamer probes for intelligent fluorescence imaging of cell membrane receptors[J]. Sensors and Actuators B:Chemical, 2017, 241: 422–429. DOI:10.1016/j.snb.2016.10.099 |
| [25] | Fang Y, Chen W, Shi W. A near-infrared fluorescence off-on probe for sensitive imaging of hydrogen polysulfides in living cells and mice in vivo[J]. Chemical Communication, 2017, 53(62): 8759–8762. DOI:10.1039/C7CC04093H |
| [26] | Hao Q, Qiu T, Chu P K. Surfaced-enhanced cellular fluorescence imaging[J]. Progress in Surface Science, 2012, 87(1): 23–45. |
| [27] | Cask K J, Li C, Wang L V. Optical drug monitoring:photoacoustic imaging of nanosensors to monitor therapeutic lithium in vivo[J]. ACS Nano, 2015, 9(2): 1692–1698. DOI:10.1021/nn5064858 |
| [28] | Culver J, Akers W, Achilefu S. Multimodality molecular imaging with combinedoptical and SPECT/PET modalities[J]. Journal of Nuclear Medicine, 2008, 49(2): 169–172. DOI:10.2967/jnumed.107.043331 |
| [29] | Lauterbur P C. Image formation by induced local interactions:examples employing nuclear magnetic resonance[J]. Nature, 1973, 242(5394): 190–191. DOI:10.1038/242190a0 |
| [30] | Gore J C, Zu Z L, Wang P, Li H, Gochberg D F. Molecular MR imaging at high fields[J]. Magnetic Resonance Imaging, 2017, 38: 95–100. DOI:10.1016/j.mri.2016.12.008 |
| [31] | Hu D, Chen M, Gao Y, Li F Y, Wu L M. A facile method to synthesize superparamagnetic and up-conversion luminescent NaYF4:Yb, Er/Tm@SiO2@Fe3O4 nanocomposite particles and their bioapplication[J]. Journal of Materials Chemistry B, 2011, 21(30): 11276–11282. DOI:10.1039/c1jm11172h |
| [32] | Zhu H, Shang Y L, Wang W H, Zhou Y J, Li P H, Shen K J, Sun L D, Zhang Y W, Yan C H. Superparamagnetic and upconversion emitting Fe3O4/NaYF4:Yb, Er hetero-nanoparticles via a crosslinker anchoring strategy[J]. Chemical Communication, 2010, 46(31): 5731–5733. DOI:10.1039/c0cc00814a |
| [33] | Zhu H, Shang Y L, Wang W H, Zhou Y J, Li P H, Yan K, Wu S L, Yeung K W K, Xu Z S, Xu H B, Chu P K. Fluorescent magnetic Fe3O4 rare earth colloidal nanoparticles for dual-modality imaging[J]. Small, 2013, 9(17): 2991–3000. DOI:10.1002/smll.v9.17 |
| [34] | Hamilton J, Franson D, Seiberlich N. Recent advances in parallel imaging for MRI[J]. Progress in Nuclear Magnetic Resonance Spectroscopy, 2017, 101: 71–95. DOI:10.1016/j.pnmrs.2017.04.002 |
| [35] | Michael J H, Rispoli J, Mary B. Clinical utility for diffusion MRI sequence in emergency and inpatient spine protocols[J]. Clinical Imaging, 2017, 45: 37–50. DOI:10.1016/j.clinimag.2017.05.021 |
| [36] | Mohan G, Subashini M. MRI based medical image analysis:survey on brain tumor grade classification[J]. Biomedi-cal Signal Processing and Control, 2018, 39: 139–161. DOI:10.1016/j.bspc.2017.07.007 |
| [37] | Likeman M. MRI brain imaging in neonates[J]. Paediatrics and Child Health, 2014, 24(9): 407–412. DOI:10.1016/j.paed.2014.02.005 |
| [38] | Lin Q, Sun Y, Li C G, Zhou J, Li C Y, Yang T S, Zhang X Z, Yi T, Wu D M, Li F Y. 18F-labeled magnetic-upconversion nanophosphors via rare-earth cation-assisted ligand assembly[J]. ACS Nano, 2011, 5(4): 3146–3157. DOI:10.1021/nn200298y |
| [39] | Ametamey S M, Honer M, Schubiger P A. Molecular Imaging with PET[J]. Chemistry Review, 2008, 108(5): 1501–1516. DOI:10.1021/cr0782426 |
| [40] | Devaraj N K, Keliher E J, Thurber G M. 18F labeled nanoparticles for in vivo PET-CT imaging[J]. Bioconjugate Chemistry, 2009, 20(2): 397–401. DOI:10.1021/bc8004649 |
| [41] | Sun Y, Yu M X, Liang S, Zhang Y J, Li C G, Mou T T, Yang W J, Zhang X Z, Li B, Huang C H, Li F Y. Fluorine-18 labeled rare-earth nanoparticles for positron emission tomography (PET) imaging of sentinel lymph node[J]. Biomaterials, 2011, 32(11): 2999–3007. DOI:10.1016/j.biomaterials.2011.01.011 |
| [42] | Hartman K B, Hamlin D K, Wilbur D S, Wilson L J. 211AtCl@US-tube nanocapsules:a new concept in radiotherapeutic-agent design[J]. Small, 2007, 3(9): 1496–1499. DOI:10.1002/(ISSN)1613-6829 |
| [43] | Unaka G, Ozkayab F, Medine E I. Gold nanoparticle probes:design and in vitro applications in cancer cell culture[J]. Colloids and Surfaces B:Biointerfaces, 2012, 90(1): 217–226. |
| [44] | Rojas S, Gispert J D, Abad S. In vivo biodistribution of amino-functionalized ceria nanoparticles in rats using positron emission tomography[J]. Molecular Pharmaceutics, 2012, 9(12): 3543–3550. DOI:10.1021/mp300382n |
| [45] | Carroll L, Witney T H, Aboagye E O. Design and synthesis of novel 18F-radiolabelled glucosamine derivatives for cancer imaging[J]. Medicinal Chemical Communication, 2013, 4(4): 653–656. DOI:10.1039/c3md00023k |
| [46] | Rudin M, Weissleder R. Molecular imaging in drug discovery and development[J]. Nature Review, 2003, 2(2): 123–131. |




