2. 中国科学院 理化技术研究所, 北京 100190
2. Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Beijing 100190, P. R. China
手性是表达化合物分子结构不对称性的术语,手性广泛存在于药物、食品、生命科学等领域,赋予了物质特定的功能和性质。氨基酸是合成蛋白质的重要原料,为生物的新陈代谢、生命活动和生长发育提供了重要的物质基础。作为手性分子(除甘氨酸外),不同构型的氨基酸在生命科学及其他领域发挥着不同的作用。如生物界中的蛋白质都是由L-氨基酸缩合得到的,D-氨基酸不能用于蛋白质的合成,两者混用可能会对生物体产生毒害作用[1]。L-色氨酸(L-Trp)被称为第二氨基酸,其代谢产物5-羟色胺促进睡眠和精神稳定,补充L-Trp可明显缓解抑郁症患者的病情[2]。D-色氨酸(D-Trp)是一种非蛋白质氨基酸,是抗癌和免疫药物的重要前驱体。由于L-Trp和D-Trp发挥着不同的作用,因此对Trp对映体的识别有十分重要的意义。目前,Trp对映体的检测方法包括毛细管电泳法[3]、高效液相色谱法[4]和电化学方法[5, 6]等,其中电化学方法因成本低、灵敏度高及稳定性好等优点而引起了科研工作者的广泛关注[7, 8]。纳米材料(如碳纳米管[9]、石墨烯[10]、金纳米粒子[11]等)和手性识别剂(包括多糖[12]、蛋白[13]等)复合可显著地提高电化学传感器的灵敏度。Gu等[14]通过电沉积法, 采用CS或磺化壳聚糖(SCS)修饰玻碳电极,实现了Trp对映异构体的电化学识别。Tao等[15]用高度有序的CS和Cu-β-环糊精复合材料修饰玻碳电极(CS/Cu-β-CD/GCE),通过差示脉冲伏安法(Differential pulse voltammetry, DPV)实现了Trp对映异构体的识别。结果显示,在30℃时,L-Trp的氧化峰电流与D-Trp的氧化峰电流比值高达7.26。但是,以上电化学传感器多采用玻碳电极,成本较高,且电极修饰工艺复杂、耗时长。
石墨烯(graphene)具有高导电性、高热传导性、高透明度、高强度、大比表面积和易化学修饰等优点[16, 17]。壳聚糖3位和5位氧原子形成的分子内氢键使其与DNA分子类似,分子链呈螺旋结构[18],具有旋光性,并且具有生物相容性及可降解等优点。截止目前,石墨烯/CS复合物在生物医药[19]、重金属吸附[20]、电化学传感器[21]等领域得到了比较广泛的应用,但是,石墨烯和CS构成的薄膜结构直接用于电化学检测的电极材料还未见报道。
为了降低成本,提高电化学传感器的电流响应,本研究以石墨烯作为导电材料,CS作为手性识别剂,在氧化铟锡(ITO)玻璃表面制备了石墨烯/CS的复合薄膜,用于Trp对映异构体的电化学选择性识别。该方法从氧化石墨烯(GO)的制备出发,由抗坏血酸还原制备了稳定分散的还原氧化石墨烯(RGO)和CS的分散液(RGO/CS)[22],通过真空抽滤法将RGO/CS复合物薄膜均匀沉积于ITO玻璃表面,得到RGO/CS@ITO电极。该方法具有制备工艺简单、廉价、灵敏度高的特点。通过DPV法分别检测了L-Trp、D-Trp及不同含量的L-Trp和D-Trp混合物溶液,结果表明,RGO/CS复合物电极对L-Trp有更高的电流响应,实现了Trp对映体的识别。该识别方法有望用于分子药物及临床医学领域中手性对映体的识别。
1 实验部分 1.1 药品与仪器药品:天然石墨粉,山东青岛华泰润滑密封有限公司;去离子水,国药集团化学试剂有限公司;十二水合磷酸二氢钠(分析纯)、十二水合磷酸氢二钠(分析纯),国药集团化学试剂有限公司;氯化钾、冰醋酸(分析纯)、硫代硫酸钠、氢氧化钠、高锰酸钾(分析纯)、五氧化二磷、硫酸(分析纯)、硝酸(分析纯)、盐酸(分析纯),北京化工厂;壳聚糖、亚铁氰化钾(分析纯)、铁氰化钾(分析纯)、抗坏血酸、L-和D-色氨酸,均为阿拉丁公司产品;ITO玻璃,广东省佛山市源晶美玻璃有限公司;阳极氧化铝膜(AAO,47 mm,0.02 μm),英国Whatman公司。
仪器:Bruker D8-focus X射线粉末衍射仪,德国布鲁克公司;Excalibur 3100傅里叶变换红外光谱仪,美国Varian公司;InVia-Reflex显微共焦激光拉曼光谱仪,英国Renishaw公司;ESCALAB 250Xi X射线光电子能谱仪,英国赛默飞世尔科技公司;JEM-2100透射电子显微镜(TEM),日本电子株式会社;Hitachi S-4800型扫描电子显微镜(SEM),日本日立公司;J-815圆二色光谱仪,日本分光公司;Chi660E电化学工作站,北京华科普天科技有限公司。
1.2 石墨烯/壳聚糖复合物电极的制备 1.2.1 GO的制备GO由改进的Hummer法制备[23],通过离心分离得到GO水凝胶,用于石墨烯和CS复合物的制备。
1.2.2 RGO/CS复合物的制备将CS(25 mg)加入醋酸溶液中(0.1 mol·L-1, 100 mL),搅拌至溶解,获得0.25 mg·mL-1的CS酸溶液。移取8 mL(0.25 mg·mL-1)CS酸溶液于玻璃瓶中,搅拌下缓慢滴加8 mL(1 mg·mL-1)GO溶液,超声30 min获得分散均匀的混合溶液。向混合溶液中加入抗坏血酸(80 mg),于60 ℃下搅拌6 h,使GO还原得到RGO。向混合溶液中滴加氢氧化钠溶液,pH值调节为7,取200 μL上述混合液,稀释至250 mL,超声,抽滤,获得沉积于AAO基底的RGO/CS复合物薄膜。
1.2.3 RGO/CS@ITO电极的制备取适量NaOH溶液(3 mol·L-1)于培养皿中,把沉积于AAO基底的RGO/CS复合物薄膜轻轻放置于NaOH溶液的表面上,待氧化铝模板腐蚀溶解后,用去离子水交换多次,待溶液的pH值为7时,将处理好的ITO玻璃放入培养皿中,通过抽滤,使复合物薄膜沉积于ITO表面,60 ℃下干燥8 h[24]。把RGO/CS@ITO裁切作为工作电极(0.5 cm2)备用。
1.3 DPV法测试Trp对映异构体以RGO/CS@ITO为工作电极,饱和甘汞电极为参比电极,铂电极为对电极,采用DPV法,检测Trp的对映异构体。Trp溶解于PBS缓冲溶液(0.1 mol·L-1 PBS,pH为7.0)用于DPV检测。电压范围:0.2~1.2 V,电压增量:0.01 V,振幅:0.05 V,脉冲宽度:0.2 s。以ITO电极作为对比试验时,L-/D-Trp溶液的浓度均为1.0 mmol·L-1;以RGO/CS@ITO作为工作电极,L-/D-Trp溶液的浓度为:0.3 mmol·L-1、0.5 mmol·L-1、0.7 mmol·L-1、1 mmol·L-1、1.2 mmol·L-1、1.5 mmol·L-1。L- Trp和D-Trp混合物溶液的总浓度为1.0 mmol·L-1,其中L-Trp组分的含量依次为10%、20%、40%、60%、80%。
2 结果与讨论 2.1 RGO/CS电极制备GO易分散于水,且导电性差,因此不适合用于制备稳定的薄膜电极;经抗坏血酸还原得到的RGO在水中的分散性较差,导电性高,制备的RGO薄膜在水溶液中可作为稳定的电极材料使用。GO在CS存在的条件下经抗坏血酸还原得到RGO/CS的复合物,该复合物的分散性优于RGO,通过抽滤可获得均匀分布于AAO基底的RGO/CS薄膜,将其转移到ITO基底得到RGO/CS@ITO电极。
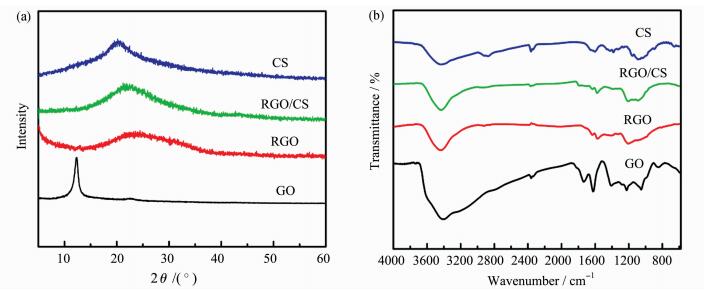
2.2 结构与性能测试 2.2.1 RGO/CS复合物结构表征图 1(a)是CS、GO、RGO、RGO/CS的XRD图。可以看出,GO在2θ =11.5°有一个尖锐的衍射峰。经抗坏血酸还原后,GO片层表面上的环氧基团减少,故其原有的衍射峰消失,在2θ =25°处出现一个新的较宽的衍射峰,对应于RGO的(002)晶面[25]。CS在2θ =20°处有一个明显的衍射峰。相比于RGO和CS,RGO/CS的衍射峰出现在2θ =22°附近,与RGO的衍射峰相比向小角区移动,说明通过与CS的复合,RGO/CS复合物中具有更大的层间距[26]。
|
图 1 CS、GO、RGO和RGO/CS的X射线衍射(a)和红外图谱(b) Fig.1 (a) XRD patterns and (b) FT-IR spectra of CS, GO, RGO and RGO/CS |
采用FT-IR光谱技术,对CS、GO、RGO、RGO/CS进行表征,结果如图 1(b)所示,GO样品在3413 cm-1和1732 cm-1的吸收峰分别对应于O—H键C=O键的伸缩振动[27]。1050 cm-1处的吸收峰归属于GO片层表面的环氧基团C—O—C键的不对称伸缩振动。GO经抗坏血酸还原后,归属于环氧基团的吸收峰消失。CS样品在3400 cm-1处附近有一个宽带吸收峰,源于—OH和—NH的伸缩振动吸收的叠加;而在1650 cm-1处的吸收峰源于酰胺键的振动;此外,在1120 cm-1的吸收峰归属于二级羟基—C2OH的振动,在900~890 cm-1附近的信号属于多糖的β-构型糖苷键吸收[28]。对于RGO/CS样品,在其FT-IR光谱观察到对应于RGO和CS的特征吸收峰。
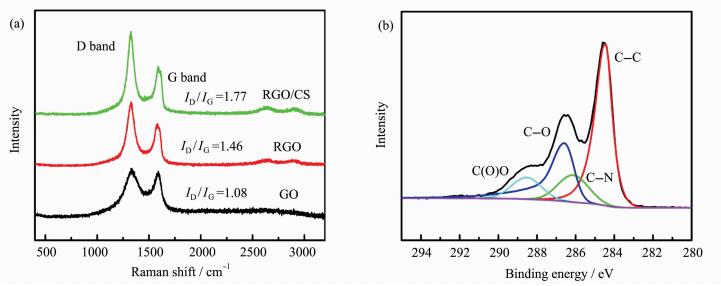
2.2.2 RGO/CS复合物中界面作用的表征图 2(a)为GO、RGO和RGO/CS的拉曼光谱图,3个材料均在1330和1590 cm-1处出现了两个主要的峰,分别为石墨烯材料的D带和G带,代表石墨烯片层的无序和有序结构[29]。GO、RGO和RGO/CS的D带和G带强度比分别为1.08、1.46和1.77,这一结果与通过GO还原制备RGO的文献报道一致[30],化学还原导致其片层结构中小尺寸的共轭结构增加。材料的表面功能性是决定材料性能的关键因素。图 2(b)为RGO/CS的C1s XPS谱图,拟合分峰在284.7、286.2、286.8和288.5 eV处得到信号峰,它们分别对应于C—C、C—N、C—O和C(O)O[31]的结合能,进一步证明GO的还原和RGO/CS复合物形成。
|
图 2 (a) GO、RGO和RGO/CS的拉曼光谱;(b) RGO/CS的C1s XPS高分辨图谱 Fig.2 (a)Raman spectra recorded for GO, RGO and RGO/CS; (b) high-resolution C1s XPS spectrum recorded for RGO/CS composite |
图 3(a)为RGO/CS薄膜的透射电子显微镜(TEM)图片,可以看出,CS分散在RGO片层表面呈颗粒状分布,RGO片层具有明显的褶皱结构[32]。图 3(b)为沉积在ITO玻璃上的RGO/CS薄膜的扫描电子显微镜(SEM)图片,可以看出,薄膜表面具有明显的突起,这是RGO/CS复合物片层堆积的结果。在真空制膜的过程中,负载着CS的RGO片均匀组装,片片紧密叠加,分布在RGO片层表面及层间的CS造成了复合物薄膜粗糙的形貌。

|
图 3 RGO/CS的TEM图片(a)和RGO/CS薄膜的SEM图片(b) Fig.3 (a) The TEM image of RGO/CS; (b) SEM image of RGO/CS film deposited on ITO slide |
以RGO/CS@ITO为工作电极,通过DPV法研究了L-/D-Trp电化学行为。图 4(a)为L-Trp和D-Trp的DPV曲线,可以看出,随着电压的增加,电流密度逐渐升高,在0.7 V处出现L-Trp和D-Trp的氧化峰,并且,L-Trp的峰电流强度明显比D-Trp的高(比值为1.2),证明RGO/CS@ITO电极对L-Trp的识别效果更强。CS链的螺旋结构为RGO/CS复合物薄膜创造了手性环境,据文献报道,CS对D-Trp比对L-Trp有更强的氢键作用,因此,CS抑制了D-Trp在RGO表面的分子链运动,L-Trp更容易被氧化,从而L-Trp在DVP检测中给出比D-Trp更强的氧化电流。作为对比,从图 4(b)可以看出L-和D-Trp对ITO电极在0.2~1.2 V范围的电流密度基本相同,说明ITO对Trp对映体无识别效果。

|
图 4 以RGO/CS@ITO为工作电极(a)和以ITO为工作电极(b)Trp对映异构体的DPV曲线 Fig.4 DPV curves recorded for Trp enantiomers using RGO/CS@ITO as working electrode (a) and using ITO as working electrode (b) |
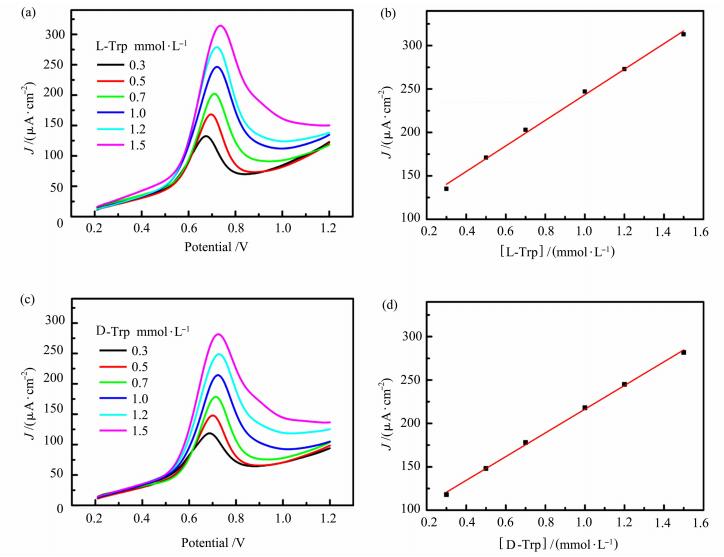
为了定量说明RGO/CS复合物电极对Trp对映异构体的手性识别效果,我们针对不同浓度的L-Trp和D-Trp溶液进行了DPV测试, 如图 5(a)和5(c)所示,发现随浓度的增加,Trp对映异构体的氧化峰及电流密度逐渐增加。将峰电流密度和Trp对映异构体浓度作图,如图 5(b)和5(d)所示,在0.3 ×10-4~1.5×10-4 mol·L-1范围内,峰电流密度与Trp对映异构体浓度呈线性关系,因此,RGO/CS复合物电极在较大的浓度范围内可实现对Trp对映异构体的选择性识别,对L-Trp异构体具有更灵敏的识别效果。
|
图 5 以RGO/CS@ITO为工作电极,不同浓度L-Trp溶液的DPV曲线(a)及峰电流密度与浓度的线性关系(b);以RGO/CS@ITO为工作电极,不同浓度D-Trp溶液的DPV曲线(c)及峰电流密度与浓度的线性关系(d) Fig.5 DPV curves recorded for L-Trp solutions at various concentrations using RGO/CS@ITO as working electrode (a) and the linear relationship between the peak current density and the concentration of L-Trp solutions (b); DPV curves recorded for D-Trp solutions at various concentrations using RGO/CS@ITO as working electrode (c) and the linear relationship between the peak current density and the concentration of D-Trp solutions (d) |
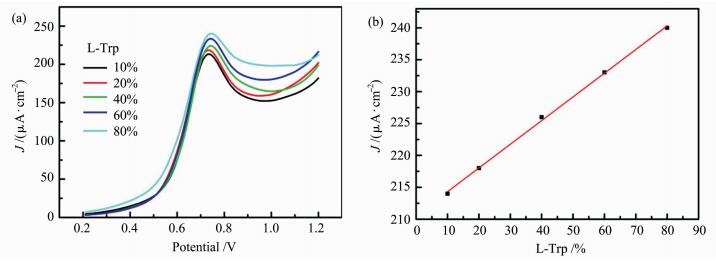
对映异构体混合物的手性识别在实际应用中具有更大的价值。然而,目前手性识别大多是在纯的L-或D-氨基酸溶液中进行。我们制备了一组具有不同L构型和D构型组成的Trp对映异构体混合物溶液,如图 6(a)所示,DPV法检测表明,随L-Trp组分比例的增加,Trp对映异构体混合物溶液的峰电流密度逐渐增加,并且,峰电流密度和L-Trp在混合物溶液中含量呈线性关系, 如图 6(b)所示。因此,RGO/CS复合物电极具有在对映异构体混合物中进行手性检测的能力。
|
图 6 以RGO/CS@ITO为工作电极,不同组成的Trp对映异构体混合物的DPV曲线(a)和峰电流密度与混合物中L-Trp组分浓度的线性关系(b) Fig.6 DPV curves recorded for the mixture of Trp enantiomers at various ratios of L-Trp to D-Trp (a) and the linear relationship between peak current density and the content of L-Trp in the mixture of Trp enantiomers (b) |
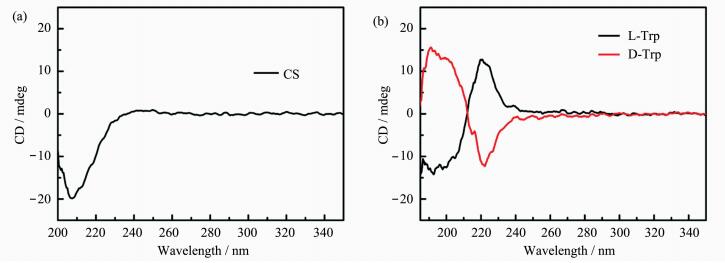
图 7(a)为CS溶液(1 mg·mL-1)的圆二色光谱(CD)曲线,在210 nm处有明显的负带吸收,该吸收带可归因于CS分子链乙酰基团的n→π*电子跃迁,负带吸收值约为-20 mdge,说明CS分子链呈L螺旋构型[33]。由图 7(b)可知,L-Trp溶液(0.001 mg·mL-1)在230 nm附近有正带吸收,这源于L-Trp结构中芳香环间的堆积作用,正带吸收值约为13 mdge[34],与L-Trp溶液相反,D-Trp溶液呈现负带吸收。
|
图 7 壳聚糖(a)和色氨酸对映体(b)的CD光谱图 Fig.7 The CD spectra of CS (a) and L-/D-Trp (b) |
本研究以CS作为手性识别剂,CS负载于石墨烯片表面(图 3),其分子链上的手性碳原子和分子链的螺旋结构为RGO/CS复合物提供手性环境,为Trp对映异构体的选择性识别提供了可能性。由RGO/CS复合物的形貌(图 3)可知,CS分子链负载于RGO片层的表面,在通过抽滤法制备薄膜的过程中,RGO/CS复合物片层紧密堆砌叠加,形成厚度均匀的薄膜,同时,分布在RGO片层表面及片层间的CS造成了复合物薄膜表面较粗糙的形貌。RGO/CS@ITO电极对Trp对映异构体的选择性识别源于CS对Trp对映异构体的选择性作用。
3 结论本文从RGO和CS的复合物设计出发,通过真空抽滤法制备了RGO/CS@ITO电极,用于Trp对映体的电化学选择性识别。实验证明,L-Trp比D-Trp具有更高的电化学响应,并且峰电流密度和Trp的浓度在0.3×10-4~1.5×10-4 mol·L-1范围内有线性关系。RGO/CS@ITO电极具有面积和厚度可控、稳定性高等优点,显著提高了电流信号,能够灵敏地识别Trp对映体,有望用于分子药物及临床医学领域中手性对映体的识别。
致谢 本论文工作受到国家自然科学基金(21462042,21262036,51773211)的支持,在此表示感谢。| [1] |
Gopal R, Chang H S, Song P I, Park Y. Effect of repetitive lysine-tryptophan motifs on the bactericidal activity of antimicrobial peptides[J]. Amino Acid, 2013, 44(2): 645–660.
DOI:10.1007/s00726-012-1388-6 |
| [2] |
Sloan M J, Phillips R S. Effects of alpha-deuteration and of aza and thia analogs of L-tryptophan on formation of intermediates in the reaction of Escherichia coli tryptophan indole-lyase[J]. Biochemistry, 1996, 35(50): 16165–16173.
DOI:10.1021/bi961211c |
| [3] |
Simionato A V, Moraes E P, Carrilho E, Tavares M F, Kenndler E. Determination of amino acids by capillary electrophoresis-electrospray ionization-mass spectrometry:an evaluation of different protein hydrolysis procedures[J]. Electrophoresis, 2008, 29(10): 2051–2058.
DOI:10.1002/(ISSN)1522-2683 |
| [4] |
Zhen Q N, Xu B, Ma L, Tian G, Tang X F, Ding M. Simultaneous determination of tryptophan, kynurenine and 5-hydroxytryptamine by HPLC:application in uremic patients undergoing hemodialysis[J]. Clinical Biochemistry, 2011, 44(2): 226–230.
|
| [5] |
Zor E, Patir I H, Bingol H, Ersoz M. An electrochemical biosensor based on human serum albumin/graphene oxide/3-aminopropyltriethoxysilane modified ITO electrode for the enantioselective discrimination of D-and L-tryptophan[J]. Biosensors & Bioelectronics, 2013, 42(1): 321–325.
|
| [6] |
Feng W L, Liu C, Lu S Y, Zhang C Y, Zhu X H, Liang Y, Nan Y M. Electrochemical chiral recognition of tryptophan using a glassy carbon electrode modified with β-cyclodextrin and graphene[J]. Microchimica Acta, 2014, 181(5-6): 501–509.
DOI:10.1007/s00604-014-1174-0 |
| [7] |
Xu C X, Huang K J, Fan Y, Wu Z W, Li J, Gan T. Simultaneous electrochemical determination of dopamine and tryptophan using a TiO2-graphene/poly(4-aminobenzenesulfonic acid) composite film based platform[J]. Materials Science & Engineering C, 2012, 31(4): 969–974.
|
| [8] |
Xu T, Jia X, Chen X, Ma Z F. Simultaneous electrochemical detection of multiple tumor markers using metal ions tagged immunocolloidal gold[J]. Biosensors & Bioelectronics, 2014, 56(3): 174–179.
|
| [9] |
Peng D M, Yu L Y, Yu J G, Peng F, Guang Z, Zhang T. Preparation of D-tartaric acid modified multi-walled carbon nanotubes for resolution of propranolol enantiomers[J]. Current Nanoscience, 2013, 9(5): 631–634.
DOI:10.2174/15734137113099990061 |
| [10] |
Feng W L, Liu C, Lu S Y, Zhang C Y, Zhu X H, Liang Y, Nan Y M. Electrochemical chiral recognition of tryptophan using a glassy carbon electrode modified with β-cyclodextrin and graphene[J]. Microchimica Acta, 2014, 181(5-6): 501–509.
DOI:10.1007/s00604-014-1174-0 |
| [11] |
Huang H, Yue Y, Li L, Zhu J J. Rare earth oxide Dy2O3-Au nanocomposite-based electrochemical sensor for sensitive determination of nitrite[J]. Journal of the Electrochemical Society, 2017, 164(6): H321–H325.
DOI:10.1149/2.0871706jes |
| [12] |
Bao L P, Tao Y X, Gu X G, Yang B Z, Deng L H, Kong Y. Potato starch as a highly enantioselective system for temperature-dependent electrochemical recognition of tryptophan isomers[J]. Electrochemistry Communications, 2016, 64: 21–25.
DOI:10.1016/j.elecom.2016.01.004 |
| [13] |
Liu B D, Zhang X, Ding Y P, Luo L Q, Zhang F F. Enantioselective discrimination of L-/D-phenylalanine by bovine serum albumin and gold nanoparticles modified glassy carbon electrode[J]. Analytical Methods, 2015, 7(7): 3022–3027.
DOI:10.1039/C4AY02975E |
| [14] |
Gu X, Tao Y, Yan P, Deng L H, Bao L P, Kong Y. DNA-inspired electrochemical recognition of tryptophan isomers by electrodeposited chitosan and sulfonated chitosan[J]. Analytical Chemistry, 2015, 87(18): 9481–9486.
DOI:10.1021/acs.analchem.5b02683 |
| [15] |
Tao Y X, Gu X G, Yang B Z, Deng L H, Bao L H, Kong Y, Chu F Q, Qin Y. Electrochemical enantioselective recognition in a highly ordered self-assembly framework[J]. Analytical Chemistry, 2017, 89(3): 1900–1906.
DOI:10.1021/acs.analchem.6b04377 |
| [16] |
Fang H M, Bai S L, Wong C P. "White graphene"-hexagonal boron nitride based polymeric composites and their application in thermal management[J]. Composites Communications, 2016, 3: 19–24.
|
| [17] |
Sun J H, Memon M A, Bai W, Xiao L H, Zhang B, Jin Y D, Huang Y, Geng J X. Controllable fabrication of transparent macroporous graphene thin films and versatile applications as a conducting platform[J]. Advanced Functional Materials, 2015, 25(27): 4334–4343.
DOI:10.1002/adfm.v25.27 |
| [18] |
Lertworasirikul A, Yokoyama S, Noguchi K, Ogawa K, Okuyama K. Molecular and crystal structures of chitosan/HI type Ⅰ salt determined by X-ray fiber diffraction[J]. Carbohydrate Research, 2004, 339(4): 825–833.
DOI:10.1016/j.carres.2004.01.001 |
| [19] |
Jones S, Pramanik A, Kanchanapally R, Nellore B P V, Begum S, Sweet C, Rays P C. Multifunctional three-dimensional chitosan/gold nanoparticle/graphene oxide architecture for separation, label-free SERS identification of pharmaceutical contaminants, and effective killing of superbugs[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(7): 7175–7187.
|
| [20] |
Yu P, Wang H Q, Bao R Y, Liu Z Y, Yang W, Xie B H, Yang M B. Self-assembled sponge-like chitosan/reduced graphene oxide/montmorillonite composite hydrogels without crosslinking of chitosan for effective Cr(Ⅵ) sorption[J]. ACS Sustainable Chemistry & Engineering, 2016, 5(2): 1557–1566.
|
| [21] |
Liu J Y, Wang X H, Wang T S, Li D, Xi F N, Wang J, Wang E K. Functionalization of monolithic and porous three-dimensional graphene by one-step chitosan electrodeposition for enzymatic biosensor[J]. ACS Applied Material&Interfaces, 2014, 6(22): 19997–20002.
|
| [22] |
Fang M, Long J, Zhao W F, Wang L W, Chen G H. pH-Responsive chitosan-mediated graphene dispersions[J]. Langmuir, 2010, 26(22): 16771–16774.
DOI:10.1021/la102703b |
| [23] |
Hummers W S, Offeman R E. Preparation of graphitic oxide[J]. Journal of the American Chemical Society, 1958, 80(6): 1339–1339.
DOI:10.1021/ja01539a017 |
| [24] |
Geng J X, Jung H T. Porphyrin functionalized graphene sheets in aqueous suspensions:from the preparation of graphene sheets to highly conductive graphene films[J]. Journal of Physical Chemistry C, 2010, 114(18): 8227–8234.
DOI:10.1021/jp1008779 |
| [25] |
Zhang J L, Yang H J, Shen G X, Cheng P, Zhang J Y, Guo S W. Reduction of graphene oxide via L-ascorbic acid[J]. Chemical Communications, 2010, 46(7): 1112–1114.
DOI:10.1039/B917705A |
| [26] |
Kumar S, Koh J. Physiochemical and optical properties of chitosan based graphene oxide bionanocomposite[J]. International Journal of Biological Macromolecules, 2014, 70(8): 559–564.
|
| [27] |
Li B P, Hou W P, Sun J H, Jiang S D, Xu L L, Li G X, Memon M A, Cao J H, Huang Y, Bielawski C W, Geng J X. Tunable functionalization of graphene oxide sheets through surface-initiated cationic polymerization[J]. Macromolecules, 2015, 48(4): 994–1001.
DOI:10.1021/ma5026237 |
| [28] |
Zhao G J, Jiang Y M, Sun L S, Sui D X, Shi Y C. Comparative studies on the properties and infrared spectra of chitosan from different sources[J]. Journal of Functional Polymers, 1998, 11(3): 403–407.
|
| [29] |
Yun Y S, Park M H, Hong S J, Lee M E, Park Y W, Jin H J. Hierachically porous carbon nanosheets from waste coffee grounds for supercapacitors[J]. ACS Applied Material & Interfaces, 2015, 7(6): 3684–3690.
|
| [30] |
Memon M A, Bai W, Sun J H, Imran M, Phulpoto S N, Yan S K, Huang Y, Geng J X. Conjunction of conducting polymer nanostructures with macroporous structured graphene thin films for high-performance flexible supercapacitors[J]. ACS Applied Materials & Interfaces, 2016, 8(18): 11711–11719.
|
| [31] |
Wan S J, Peng J S, Li Y C, Hu H, Jiang L, Cheng Q F. Use of Synergistic interactions to fabricate strong, tough, and conductive artificial nacre based on graphene oxide and chitosan[J]. ACS Nano, 2015, 9(10): 9830–9836.
DOI:10.1021/acsnano.5b02902 |
| [32] |
Cobos M, Gonzalez B, Jesus F M, Dolores M. Study on the effect of graphene and glycerol plasticizer on the properties of chitosan-graphene nanocomposites via in situ green chemical reduction of graphene oxide[J]. International Journal of Biological Macromolecules, 2018, 5(1): 37–43.
|
| [33] |
Lertworasirikul A, Yokoyama S, Noguchi K, Ogawa K, Okuyama K. Molecular and crystal structures of chitosan/HI type Ⅰ salt determined by X-ray fiber diffraction[J]. Carbohydrate Research, 2004, 339(4): 825–833.
DOI:10.1016/j.carres.2004.01.001 |
| [34] |
Dube T, Mandal S, Panda J J. Nanoparticles generated from a tryptophan derivative:physical characterization and anti-cancer drug delivery[J]. Amino Acids, 2017, 49(5): 1–19.
|




