量子点(quantum dots,Qdots)是一种半导体荧光纳米颗粒(fluorescent semiconductor nano-particles),具有优越的光学成像性能:成像亮度高、抗光漂白能力强、发射光谱窄而对称,这些优势使得量子点成为活体成像中非常优越的荧光标记物,在生物示踪和活体成像领域的应用引起人们的极大关注[1, 2]。
肿瘤光学成像是一种无创、高敏感度、费用相对低廉的成像方法。研究显示,由于具有更高的亮度,以量子点为基础构建的探针将肿瘤成像的灵敏度提高了10~100倍[3, 4]。通过使用量子点标记的探针,研究者对多种肿瘤进行了分子成像[5-7]。普通光学成像需要外源光照射激发探针,而同时产生的生物体荧光常常会掩盖探针的成像信号,降低成像信噪比。而不需要外源光进行激发的自发光成像避免了信噪比低的缺点,具有很高的灵敏度[8]。将量子点作为受体,和能量供体之间进行共价结合,可以制备出高亮度、波长可调节的自发光探针[9]。生物发光酶是常用的能量供体,当供体受体之间距离少于10 nm且光谱重叠时可发生“生物发光共振能量转移(bioluminescence resonance energy transfer,BRET)”[10-16]。前期研究中,自发光量子点中荧光素酶都是被固定的,不能选择性在不同的细胞中表达。2012年Dragavon等[17]第一次报道量子点可以被非结合的生物发光在宏观距离上激活,不需要量子点和荧光素酶之间的共价结合,并将这种能量转移方式称为“非结合生物发光激发荧光(fluorescence by unbound excitation from luminescence,FUEL)”。荧光素酶报告基因成像可以作为肿瘤特异性细胞成像的一种手段[18],因此,我们推测,细胞内表达的荧光素酶的生物发光也能激活量子点,而通过选择性基因表达,可以实现不同细胞的特异性自发成像。壳聚糖是一种天然多糖,生物相容性良好,常用于基因转染载体[19],所以,本研究利用天然多糖壳聚糖修饰量子点制备表面携带阳性电荷的纳米基因载体CS-Qdots,并验证使用CS-Qdots作为基因载体将生物发光酶转染肿瘤细胞后,是否可以对肿瘤进行自发光成像。
1 实验部分 1.1 材料与仪器化学试剂包括碲(Te)粉、氯化铬(CdCl2)、硼氢化钠(NaBH4)、3-巯基丙酸(3-Mercaptopropionic acid,MPA)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide, EDC]和壳聚糖(chitosan)等,均购自Sigma公司,所有试剂均为分析纯。
肝癌细胞株HepG2购自上海中科院细胞研究所,培养条件为:10%胎牛血清的RPMI1640培养液,37 ℃,5% CO2,饱和湿度。
透射电镜(transmission electron microscopy,TEM)为日本JEOL公司的JEM-200CX型,傅里叶转换红外光谱(Fourier transform infrared spectrometry,FTIR)分析使用NICOLET公司的NEXUS870型光谱仪。光谱分析使用PerkinElmer公司LS50B型荧光分光光度计,纳米粒子表面电位分析使用Brookhaven公司zata电位粒径分析仪,荧光和生物发光成像使用Xenogen公司的IVIS Spectrum全身成像系统。使用奥林巴斯FluoView FV1000激光共聚焦显微镜观察细胞内成像。
1.2 CS-Qdots纳米颗粒的制备和表征 1.2.1 NaHTe的制备将NaBH4和Te粉以摩尔比为2:1的比例准确称取后,共同加入一个事先洗净干燥的小玻璃瓶,通入N2 10 min除去氧气后用胶塞封口,用注射器注入5 mL除去氧气的纯水后,将注射器针头留在胶塞上,将针头开放端连接一个橡胶气球收集反应产生的氢气。反应玻璃瓶置于冰浴中,平稳反应至黑色Te粉完全消失,上层液体为淡淡的紫色,下层有白色盐类析出时为反应完全(大概需要5 h),上层淡紫色透明液体即为碲氢化钠(NaHTe)。
1.2.2 CdTe的制备在三口烧瓶内加入100 mL纯水,加入0.52 mL MPA作为稳定剂,磁力搅拌下加入CdCl2 0.0456 g,通入N2 30 min以除去溶解的氧气,再用1 mol/L的NaOH溶液将反应体系的pH调至9.0±0.1,始终通入N2并保持磁力搅拌。在反应体系中迅速加入上述反应中新鲜制备的NaHTe溶液100 μL,使体系中的反应前体NaHTe:Cd2+:MPA(摩尔比)为0.5:1:2.4,升温至100 ℃,在冷凝回流装置下,通入N2并保持磁力搅拌反应16 h,得到红色的水溶性CdTe胶体溶液。用旋转蒸发仪将胶体溶液浓缩至5 mL,用丙酮沉淀CdTe,离心分离沉淀后弃去上清,再次用纯水溶解CdTe,如此反应数次去除反应物残存物,至溶液pH为7.0,得到纯净的红色CdTe胶体溶液,干燥后得到晶体粉末备用。
1.2.3 CS-Qdots纳米颗粒的制备称取0.5 g Chitosan,溶于0.1 mol/L的乙酸溶液10 mL中,制备Chitosan的储备溶液。将Chitosan储备液用纯水稀释100倍后,在磁力搅拌下,逐滴加入浓度为0.1 mg/mL的CdTe胶体溶液,搅拌下逐滴加入浓度为0.5%(质量分数)的EDC水溶液0.5 mL,通入N2,室温下磁力搅拌反应过夜,得到Chitosan包裹的CdTe(Cs-Qdots)胶体溶液。1×106 r/min超速离心沉淀CS-Qdots,纯水重新悬浮后洗涤数次。
1.2.4 纳米颗粒的表征以透射电镜观察CdTe和CS-Qdots纳米颗粒的形态,荧光分光光度计测定其光谱,傅里叶转换红外光谱仪分析量子点CdTe在壳聚糖包裹前后表面基团的图谱变化,并对其表面zeta电位进行分析,动态光散射分析纳米粒子的水合粒径。
1.3 CS-Qdots被细胞吞噬和细胞内荧光成像将HepG2细胞以5×104/孔的浓度接种在6孔细胞培养板上,接种后24 h加入终浓度为100 μg/mL的CS-Qdots纳米微粒,孵育12 h后以PBS缓冲液冲洗细胞3次,去除多余的CS-Qdots纳米颗粒。然后用共聚焦显微镜观察细胞吞噬量子点的情况。
1.4 CS-Qdots携带报告基因质粒的凝胶阻滞实验pCMV-luciferase报告基因质粒为本实验室前期制备,可在真核细胞内表达虫荧光素酶。保持pCMV-luciferase质粒10 μg不变,将CS-Qdots质量从0增加至140 μg,即以纳米粒:质粒质量比范围为(0~14):1的比例混合孵育30 min后,在0.8%琼脂糖凝胶内电泳(100 V,30 min)。然后在凝胶成像仪上观察电泳情况。
1.5 HCC移植瘤裸鼠模型的制备动物实验在东南大学医学院的动物实验中心的无菌屏障系统中进行,实验操作符合江苏省动物保护协会的相关规定,由持动物实验上岗证的专业人员操作。实验所用动物为健康的BALC/c雄性裸鼠(实验动物合格证号2008001639607),四周龄,体重在18~20 g之间。在每只裸鼠后肢皮下注射指数生长肝癌肿瘤细胞HepG2(2×106个),构建移植瘤动物模型,在移植瘤直径达到0.5 cm时开始进行体内试验。
1.6 CS-Qdots/pCMV-luciferase体内外成像实验 1.6.1 生物发光激发CS-Qdots的体外细胞实验HepG2细胞接种在24孔培养板上,每接种8孔细胞中间留一个空白孔。转染24 h后以LipofectamineTM 2000(Invitrogen公司)转染pCMV-luciferase,转染后48 h加入1 mL底物荧光素钠盐(D-Luciferin, Sodium Salt)的1×工作液(150 μg/mL),同时在空白孔中加入1 mL浓度为0.1 mg/mL的CS-Qdots纳米颗粒,然后在IVIS Spectrum成像系统中观察生物发光信号。
1.6.2 CS-Qdots/pCMV-luciferase介导的体内外生物发光成像和光谱分析HepG2细胞接种入24孔培养板后,分别用CS-Qdots纳米颗粒和LipofectamineTM 2000将pCMV-luciferase转染至HepG2细胞。纳米颗粒转染细胞组以CS-Qdots:pCMV-luciferase=10:1(质量比)混合,制备转染复合体,与细胞共孵育过夜后弃去转染混合物,转染48 h以后,弃去细胞培养液,加入底物D-Luciferin(150 μg/mL),10 min后用IVIS spectrum活体成像仪分波段检测CS-Qdots/PS纳米颗粒和LipofectamineTM 2000转染后的细胞生物发光波长。
体内成像实验中,将100 μL转染复合物(含有120 μg CS-Qdots和10 μg pCMV-luciferase)直接注射至裸鼠的皮下移植瘤内,转染72 h后裸鼠腹腔注射成像底物D-Luciferin(15 mg/mL,按10 μL/g体重进行注射),底物注入10 min后用IVIS spectrum分波段检测生物发光的强度。
IVIS spectrum配有20个发射光检测光栅,覆盖190~850 nm的波段,每个光栅宽度为20 nm。我们检测了不同波长光栅下的发光强度,使用的光栅波段为:560±10 nm (550~570 nm)、600±10 nm (590~610 nm)、620±10 nm (610~630 nm)和640±10 nm (630~650 nm)。然后绘制了波长-强度曲线,分析转染后生物发光的光谱。
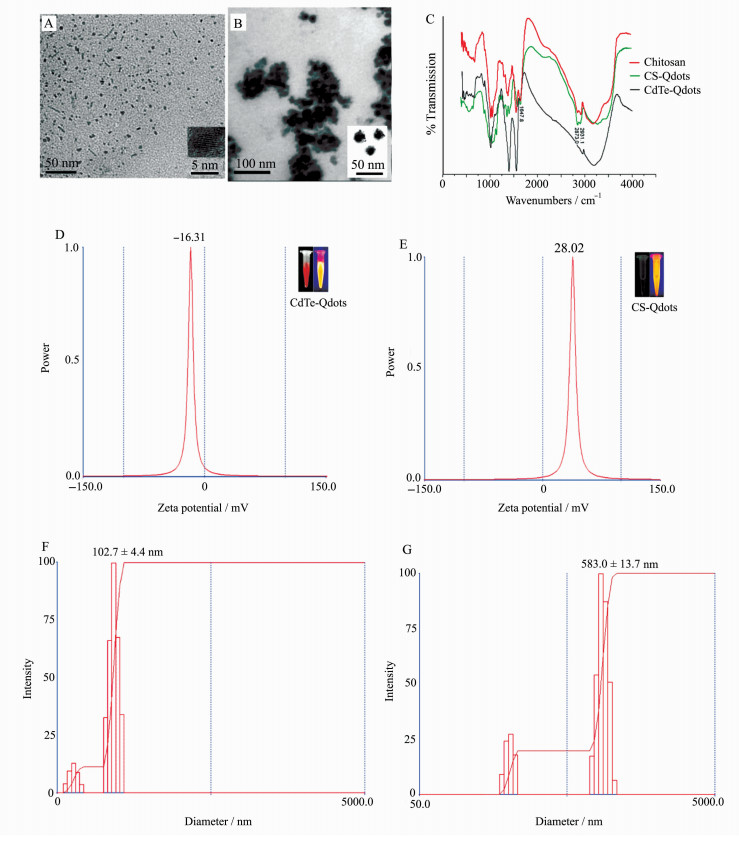
2 结果和讨论 2.1 纳米颗粒的表征结果如图 1A所示,透射电镜观察CdTe纳米晶体分散均匀、粒径大小一致,大约5 nm;图 1B显示CS-Qdots纳米颗粒呈球形,粒径大约在20~30 nm;图 1C为傅里叶转换红外光谱,显示CdTe晶体经壳聚糖修饰以后,表面基团发生改变,出现壳聚糖特有的基团。CdTe量子点表面电位是-16.31 mV(图 1D),CS-Qdots表面携带大量正电荷,zeta电位转为28.02 mV(图 1E)。经动态光散射分析纳米颗粒的水合粒径,CdTe量子点为102.7±4.4 nm(图 1F),CS-Qdots纳米颗粒为583.0±13.7 nm(图 1G)。
|
图 1 纳米颗粒表征图 (A) CdTe量子点透射电镜图;(B) CS-Qdots纳米颗粒的透射电镜图;(C) CdTe量子点、壳聚糖Chitosan和CS-Qdots纳米颗粒的傅里叶转换红外光谱;(D) CdTe量子点的zeta电位;(E) CS-Qdots纳米颗粒的zeta电位;(F)动态光散射分析CdTe量子点水合粒径为102.7±4.4 nm;(G)动态光散射分析CS-Qdots纳米颗粒水合粒径为583.0±13.7 nm Fig.1 Characteristic figures of nanoparticles (A) TEM image of CdTe Qdots; (B) TEM image of CS-Qdots; (C) FTIR spectroscopy of CdTe Qdots and CS-Qdots; (D) zeta potential of CdTe Qdots; (E) zeta potential of CS-Qdots; (F) dynamic light scattering measurements showed that the mean hydrodynamic diameter of CdTe quantum dots was 102.7±4.4 nm; (G) dynamic light scattering measurements showed that the mean hydrodynamic diameter of CS-Qdots nanoparticles was 583.0±13.7 nm |
以荧光分光光度计对不同回流时间制备的CdTe量子点进行光谱分析,如图 2所示,在吸收光谱上每个样品都有一个最大的吸收峰值,吸收光谱比较宽。发射光谱相对窄而对称,最大发射峰值与回流时间有关,回流时间越长最大发射波长越长,得到了最大发射峰值接近630 nm的量子点。
|
图 2 量子点光谱 不同回流时间制备的CdTe量子点的吸收光谱(A)和发射光谱(B) Fig.2 The spectra of CdTe quantum dots The absorption spectrum (A) and emission spectrum of CdTe quantum dots (B) prepared for different refluxing time |
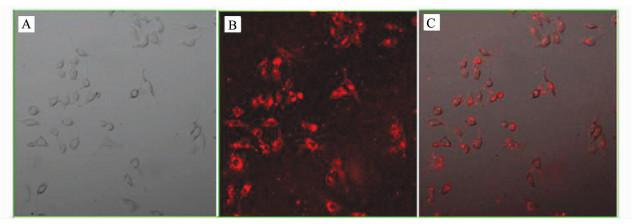
由于具有体积微小、表面携带正电荷等特性,CS-Qdots纳米颗粒很容易被细胞吞噬。如图 3所示,激光共聚焦显微镜下可见:共孵育12 h的肝癌细胞内,红色发光的纳米颗粒CS-Qdots主要集中在细胞浆内,蓝色的荧光来自细胞核染料DAPI。
|
图 3 细胞吞噬量子点的激光共聚焦显微镜图片 激光共聚焦显微镜观察与CS-Qdots (100 μg /mL)共孵育12 h的HepG2细胞(A)明场细胞图像;(B)激发CS-Qdots后细胞荧光成像;(C)二者融合图像 Fig.3 Confocal laser microscopic views of CS-Qdots uptake by cells Confocal laser microscopic views of HepG2 cells incubated with CS-Qdots (100 μg /mL) for 12 h (A) The bright field micrograph of HepG2 cells; (B)excitation of CS-Qdots and the fluorescence imaging; (C) the merge image |
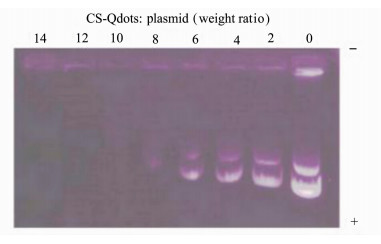
为了寻找CS-Qdots纳米颗粒和质粒DNA之间最佳的组合比例,将二者以不同的质量比混合孵育后进行琼脂糖凝胶电泳。质粒DNA携带负电荷,在电场中从负极泳向正极,当质粒DNA与CS-Qdots结合后负电荷被中和,电泳速率下降,表现为电泳阻滞,完全结合以后将不能在电场中向正极泳动。在图 4的凝胶电泳成像图中,当CS-Qdots和质粒pCMV-luciferase以10:1以上的质量比结合时已经不能再向正极泳动,意味着质粒已经完全结合在纳米颗粒上,表面负电荷完全被中和。所以在后续试验中,选用质粒:DNA为10:1(质量比)的最佳比例制备负载pCMV-luciferase的CS-Qdots纳米颗粒。
|
图 4 凝胶阻滞电泳图 图中各泳道是以不同质量比(CS-Qdots:plasmid=0~14)制备的携带pCMV-luciferase的CS-Qdots纳米颗粒的凝胶阻滞电泳 Fig.4 Agarose gel electrophoresis The agarose gel electrophoresis was to test DNA retention of CS-Qdots with pCMV-luciferase prepared at different weight ratio (0-14) |
为验证CS-Qdots是否可以被生物发光的能量在宏观距离下激发,设计了如下实验:在24孔细胞培养板上接种8孔HepG2细胞,围绕一个空白孔,用LipofectamineTM 2000对细胞进行pCMV-luciferase报告基因的转染,使其成为发光细胞。在生物发光成像仪IVIS中观察,图 5A为空白孔内没有加入CS-Qdots纳米粒时转染细胞的生物发光信号成像;图 5B是空白孔加入CS-Qdots后的荧光成像,可见仅有CS-Qdots纳米颗粒成像,周围的八孔细胞没有荧光信号;图 5C是空白孔加入CS-Qdots后检测到的生物发光信号,周围发光细胞信号猝灭,仅有中间的CS-Qdots纳米颗粒发光。虫荧光素酶报告基因的最大发射波长在560 nm左右,量子点的激发波长范围较宽,且在560 nm处有吸收峰值,推测在发光细胞和CS-Qdots纳米颗粒之间发生了能量转移。这种能量转移不同于FRET荧光共振能量转移,FRET要求能量供受体之间距离小于10 nm且光谱重叠,而在本实验中,CS-Qdots纳米颗粒的激活是一种宏观距离上的能量转移,类似于非结合的生物发光激发荧光(FUEL)[17]。
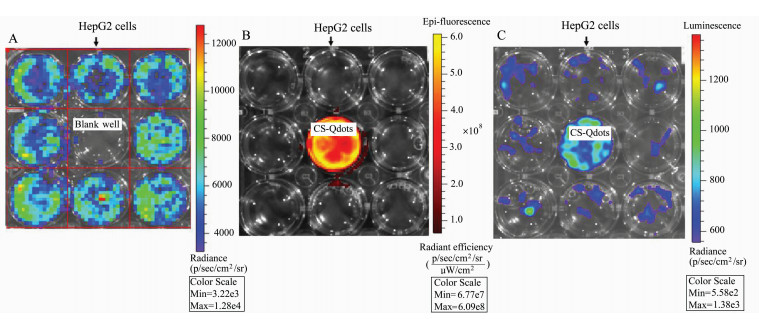
|
图 5 体外生物发光激活CS-Qdot纳米颗粒的成像图 (A) LipofectamineTM 2000转染pCMV-luciferase后的HepG2细胞生物发光成像(中央空白孔未加纳米颗粒);(B)图A的细胞培养板中央孔加入CS-Qdots后的荧光成像;(C)图A的细胞培养板中央孔加入CS-Qdots后的生物发光成像 Fig.5 Imaging of CS-Qdots excited by bioluminescence in vitro (A) Bioluminescent imaging of HepG2 cells transfected with pCMV-luciferase by LipofectamineTM 2000, the well in the center was blank; (B) fluorescent imaging of CS-Qdots which was added into the blank well surrounded by the HepG2 cells transfected with pCMV-luciferase by LipofectamineTM 2000; (C) bioluminescent imaging of the transfected HepG2 cells and CS-Qdots, the CS-Qdots was excited by the bioluminescence from the cells surrounded |
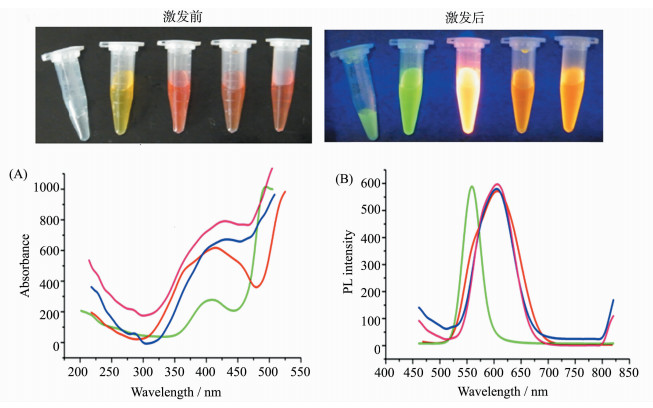
为进一步验证CS-Qdots被生物发光激发后可作为自发光探针对肿瘤细胞成像,我们利用CS-Qdots纳米颗粒将报告基因pCMV-luciferase转染至HepG2细胞,对细胞生物发光进行波长分析,观察发光信号是否从生物发光的峰值560 nm跃迁至量子点的发射峰值630 nm。以经LipofectamineTM 2000转染的细胞生物发光强度对应3个光栅的值绘制信号强度-波长曲线(图 6A,6B),在550~570 nm处有发射峰。荧光分光光度计分别检测CS-Qdots的吸收光谱(图 6C)和发射光谱(图 6D),可见吸收光谱范围广,跨越400~600 nm区间,而发射光谱窄而对称,最强发射峰值位于在630 nm波长处。如图 6E所示,以CS-Qdots作为基因载体将pCMV-luciferase转染至HepG2细胞后,以同样波长的光栅分析发射光强度并绘制信号强度-波长曲线。图 6F显示此时最大的信号强度位于630~650 nm处。在体内成像试验中,我们也证明了这一点,以CS-Qdots将pCMV-luciferase转染荷瘤小鼠的肿瘤内,转染小鼠在IVIS小动物成像系统中检测到肿瘤部位有自发光荧光信号。分别在不同光栅下分析光信号的强度(图 7B),绘制的信号-波长曲线(图 7A)显示最大光信号位于630~650 nm处。

|
图 6 pCMV-Luciferase/CS-Qdots细胞成像和光谱分析 (A) pCMV-luciferase经LipofectamineTM 2000转染至HepG2细胞以后,在不同波长的光栅下测量生物发光的强度;(B) LipofectamineTM 2000转染细胞的信号强度-波长曲线显示,最强信号位于550~570 nm纳米处,n=4;(C) CS-Qdots纳米颗粒的吸收光谱;(D) CS-Qdots纳米颗粒的发射光谱;(E) pCMV-luciferase经CS-Qdots转染至HepG2细胞以后,在不同波长的光栅下测量生物发光的强度;(F) CS-Qdots转染细胞细胞的信号强度-波长曲线显示,最强信号位于630~650 nm处,n=4 Fig.6 Cell imaging and spectra of pCMV-Luciferase/CS-Qdots Detection of the bioluminescence signal at different wave bands. (A) HepG2 cells transfected with pCMV-luciferase by LipofectamineTM 2000, bioluminescence signals were measured with three filters: 550-570 nm, 590-610 nm and 630-650 nm; (B) the signal-wavelength curve of the bioluminescence from the cells transfected by LipofectamineTM 2000, the maximal signal was at 550-570 nm, n=4; (C) the absorption spectrum of CS-Qdots, there is a absorption peak at 550-570 nm; (D) the emission spectrum of CS-Qdots; (E) HepG2 cells transfected with pCMV-luciferase by CS-Qdots, bioluminescence signals were measured with three filters; (F) the signal-wavelength curve of the bioluminescence signal from the cells transfected by CS-Qdots, the maximal signal was at 630-650 nm, n=4 |
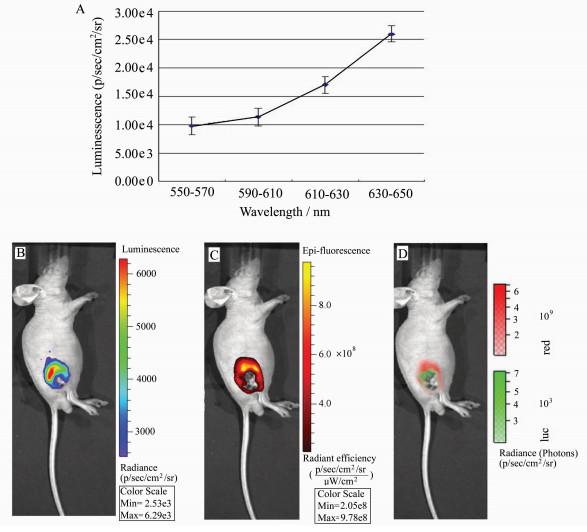
|
图 7 体内生物发光激发CS-Qdots成像和光谱分析 荷瘤裸鼠经pCMV-luciferase/CS-Qdots转染复合物瘤内注射72 h后成像。(A)荷瘤裸鼠生物发光成像信号强度-波长曲线(n=3);(B)荷瘤裸鼠生物发光成像(未使用光栅);(C)荷瘤裸鼠荧光成像;(D)荷瘤裸鼠生物发光成像和荧光成像的融合图像 Fig.7 Imaging and spectra of CS-Qdots excited by bioluminescence in vivo The mouse was injected pCMV-luciferase/CS-Qdots transfection complexes intratumorally 72 h before bioluminescence imaging. (A) Detedction of light emmission from the HCC xenografts in nude mouse with different wavelength filters and the signal-wavelength curve of the bioluminescence signal was plotted, n=3; (B) the bioluminescence imaging of the mouse aquired without a filter (total light or open); (C) the fluorescence imaging of the mouse; (D) the bioluminescence and fluorescence merge image |
实验结果显示,经CS-Qdots转染的HepG2细胞,pCMV-luciferase报告基因被运送至细胞内表达,产生的荧光素酶蛋白在细胞浆中分解底物D-Luciferin产生荧光,在非结合的状态下,激活了细胞内的CS-Qdots纳米颗粒。细胞生物发光波长发生了跃迁,从荧光素酶报告基因的峰值560 nm跃迁到CS-Qdots纳米颗粒的最大发射波长630 nm,证明在细胞内的生物发光和量子点纳米颗粒之间发生了能量的转移。所以载基因的CS-Qdots纳米颗粒可以作为一种自发光探针用于活体肿瘤细胞成像,且可以利用量子点的特性设计不同发射波长的探针以满足需要。
3 结论CS-Qdots可被细胞内生物发光能量以非结合的形式激发,载基因量子点纳米颗粒pCMV-luciferase/CS-Qdots可作为活细胞自发荧光成像的探针。荧光素酶报告基因的表达可被调控,量子点的颜色和发射波长可调节,所以该自发光探针可根据需要选择在肿瘤细胞内成像并可改变成像波长,在不同肿瘤的光学成像中具有广泛的应用前景。
| [1] |
Bruchez M J, Moronne M, Gin P, Weiss S, Alivisatos A P. Semiconductor nanocrystals as fluorescent biological labels[J]. Science, 1998, 281(5385): 2013–2016.
DOI:10.1126/science.281.5385.2013 |
| [2] |
Dahan M, Levi S, Luccardini C, Rostating P, Riveau B, Triller A. Diffusion dynamics of glycine receptors revealed by single-quantum dot tracking[J]. Science, 2003, 302(5644): 442–445.
DOI:10.1126/science.1088525 |
| [3] |
Smith A M, Gao X, Nie S. Quantum dot nanocrystals for in vivo molecular and cellular imaging[J]. Photochemistry and Photobiology, 2004, 80(3): 377–385.
DOI:10.1562/0031-8655(2004)080<0377:QDNFIV>2.0.CO;2 |
| [4] |
Weissleder R, Pittet M J. Imaging in the era of molecular oncolocy[J]. Nature, 2008, 452(7187): 580–589.
DOI:10.1038/nature06917 |
| [5] |
Voura E B, Jaiswal J K, Mattoussi H, Simon S M. Trac-king metastatic tumor cell extravasation with quantum dot nanocrystals and fluorescence emission-scanning microscopy[J]. Nature Medicine, 2004, 10(9): 993–998.
DOI:10.1038/nm1096 |
| [6] |
Stroh M, Zimmer J P, Duda D G, Levchenko T S, Cohen K S, Brown E B, Scadden D T, Torchilin V P, Bawendi M G, Fukumura D, Jain R K. Quantum dots spectrally distinguish multiple species within the tumor milieu in vivo[J]. Nature Medicine, 2005, 11(6): 678–682.
DOI:10.1038/nm1247 |
| [7] |
Sukhanova A, Devy J, Venteo L, Kaplan H, Artemyev M, Oleinikov V, Klinov D, Pluot M, Cohen J H, Nabiev I. Biocompatible fluorescent nanocrystals for immunolabeling of membrane proteins and cells[J]. Analytical Biochemistry, 2004, 324(1): 60–67.
DOI:10.1016/j.ab.2003.09.031 |
| [8] |
Frangioni J V. Self-illuminating quantum dots light the way[J]. Nature Biotechnology, 2006, 24(3): 326–328.
DOI:10.1038/nbt0306-326 |
| [9] |
So M K, Xu C, Loening A M, Gambhir S S, Rao J. Self-illuminating quantum dot conjugates for in vivo imaging[J]. Nature Biotechnology, 2006, 24(3): 339–343.
DOI:10.1038/nbt1188 |
| [10] |
Xing Y, So M K, Koh A L, Sinclair R, Rao J. Improved QD-BRET conjugates for detection and imaging[J]. Biochemical and Biophysical Research Communications, 2008, 372: 388–394.
DOI:10.1016/j.bbrc.2008.04.159 |
| [11] |
Wu Q, Chu M. Self-illuminating quantum dots for highly sensitive in vivo real-time luminescent mapping of sentinel lymph nodes[J]. International Journal of Nanomedicine, 2012, 7: 3433–3443.
|
| [12] |
Quiñones G A, Miller S C, Bhattacharyya S, Sobek D, Stephan J P. Ultrasensitive detection of cellular protein interactions using bioluminescence resonance energy transfer quantum dot-based nanoprobes[J]. Journal of Cellular Biochemistry, 2012, 113(7): 2397–2405.
DOI:10.1002/jcb.v113.7 |
| [13] |
Xing Y, Rao J. Quantum dot bioconjugates for in vitro diagnostics & in vivo imaging[J]. Cancer Biomarker, 2008, 4(6): 307–319.
DOI:10.3233/CBM-2008-4603 |
| [14] |
So M K, Loening A M, Gambhir S S, Rao J. Creating self-illuminating quantum dot conjugates[J]. Nature Protocols, 2006, 1(3): 1160–1164.
DOI:10.1038/nprot.2006.162 |
| [15] |
Hasegawa M, Tsukasaki Y, Ohyanagi T, Jin T. Bioluminescence resonance energy transfer coupled near-infrared quantum dots using GST-tagged luciferase for in vivo imaging[J]. Chemical Communications (Cambridge, England), 2013, 49(3): 228–230.
DOI:10.1039/C2CC36870F |
| [16] |
Wu C, Kawasaki K, Ohgiya S, Ohmiya Y. Chemical stu-dies on the BRET system between the bioluminescence of Cypridina and quantum dots[J]. Photochemical and Photobiological Sciences, 2011, 10(10): 534–1534.
|
| [17] |
Dragavon J, Blazquez S, Rekiki A, Samson C, Theodorou I, Rogers K L, Tournebize R, Shorte S L. In vivo excitation of nanoparticles using luminescent bacteria[J]. Proceedings of the National Academy of Sciences of the Uni-ted States of America, 2012, 109(23): 8890–8895.
DOI:10.1073/pnas.1204516109 |
| [18] |
Brogan J, Li F, Li W, He Z, Huang Q, Li C Y. Imaging molecular pathways:reporter genes[J]. Radiation Research, 2012, 177(4): 508–513.
DOI:10.1667/RR2918.1 |
| [19] |
Buschmann M D, Merzouki A, Lavertu M, Thibault M, Jean M, Darras V. Chitosans for delivery of nucleic acids[J]. Advanced Drug Delivery Reviews, 2013, 65(9): 1234–1270.
DOI:10.1016/j.addr.2013.07.005 |




