激光共聚焦显微技术是自80年代发展起来的一项高新研究技术[1-4],目前其应用已扩展到细胞学、微生物学、发育生物学、遗传学、神经科学、生理和病理学等学科,成为了生物医学成像领域中重要的研究工具[5]。它不仅可用于单色/多色荧光成像、Z轴采集和三维重构、时间序列成像、大视野拼图、荧光强度测量、荧光共定位分析,还可用于光谱扫描/光谱拆分、荧光共振能量转移(FRET)和荧光漂白后恢复实验(FRAP)等[4, 6-8]。
荧光共定位分析是对同一空间中两种或更多种不同颜色的荧光标记之间的重叠度进行分析,这是当今生物显微成像中一个极为常见的技术[9-13]。共定位分析主要用于研究2个荧光分子在组织或细胞中是否定位于同一区域或存在相关性。可用于荧光共定位分析的软件有MetaMorph、Imaris、NIS Nikon、ZEN Zeiss、ImageJ/ Fiji等。Zeiss LSM880激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)仪器自诞生以来,便在荧光共定位应用中发挥出了其独特的作用。然而大多数科研人员在使用此仪器做共定位研究时,在图像拍摄、图像分析、数据处理中存在一些比较普遍的问题,这会直接影响到共定位结果的可靠性。因此,笔者将其中一些典型问题进行了总结和归纳,希望对做荧光共定位研究的科研工作者有所帮助。
1 共定位实验的基本要求常见问题:①扫描通道设置中,2个荧光通道的光学切片厚度不一致;②比较荧光共定位效果的各张图片使用不同的拍摄参数;③图像荧光过曝;④图像中共定位效果好,但未用单独标记的对照样品来设定阈值。
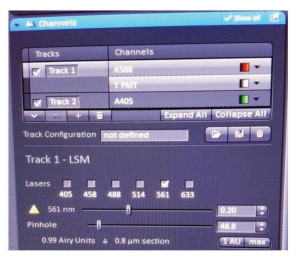
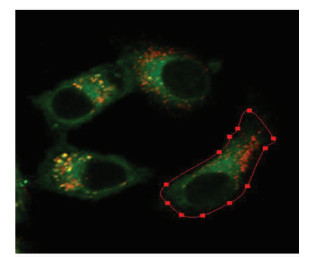
荧光共定位分析对图像扫描参数有严格的要求。①首先,避免激发光及发射光串色,保证用于荧光共定位分析的2种荧光信号之间不存在信号串扰的现象,以保证荧光信号的准确性;②其次,扫描通道设置中,需要调节2个荧光通道的Pinhole直径使光学切片厚度一致(图 1),以保证像素点大小一致;③需要比较荧光共定位效果的多张图片,各通道应使用相同的拍摄参数,从而使共定位结果具有可比性[14];④图像荧光不可过曝;⑤对于能找到单标记区域的图像(图 2),可在“Colocalization”中进行阈值的设定,对于共定位特别好的图像(图 3),必须做单独标记的对照样品来设定阈值;⑥尽量选用高数值孔径的物镜和高分辨率的显微镜进行拍摄,以获得更准确的结果。
|
图 1 Channels工具栏 Fig.1 Toolbar channels |
|
图 2 无共定位 Fig.2 Absence of colocalization |

|
图 3 有共定位 Fig.3 Colocalization |
常见问题:①在Coloc视图中,未设定单通道荧光的阈值就进行荧光共定位分析;②比较荧光共定位效果的各张图片时使用不同的阈值设定;③对于能找到单标记区域的图像,在“Colocalization”中设定阈值时,选择单通道信号的区域不正确;④未选择感兴趣区域,用整幅图像的荧光共定位效率进行分析。
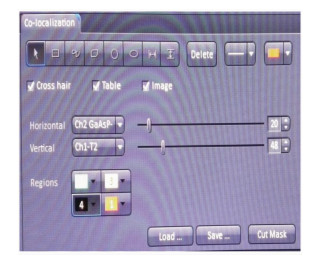
进行荧光共定位分析时,在多通道荧光图像中,每个像素点都含有至少2种荧光信号的灰度值信息(Ch1,Ch2)。首先需要在共定位软件模块下方选择感兴趣的2种荧光信号[14](图 4)。在Horizontal下拉菜单中选择散点图中X轴所代表的荧光信号,例如Ch2-T1;在Vertical下拉菜单中选择Y轴所代表的荧光信号,例如Ch1-T2。此时,散点图以Ch2和Ch1的灰度值分别作为X轴和Y轴的坐标,定义出了像素点在散点图中的位置,即图像中的每个像素点都可以根据自身Ch1和Ch2的灰度值信息,在散点图中找到自己的位置,图像中的像素点与散点图中的点一一对应。
|
图 4 Colocalization视图控制界面 Fig.4 Colocalization option control block |
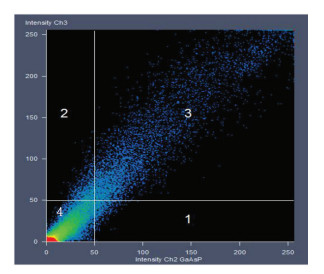
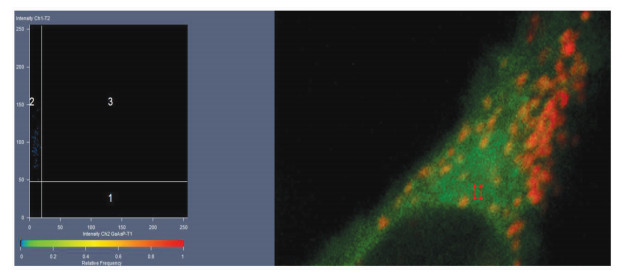
图 3的散点图见图 5。只含有荧光信号Ch2的像素点,在散点图中靠近X轴,位于区域1中;只含有Ch1的像素点靠近Y轴,位于区域2中;区域3中的点为同时含有Ch1和Ch2的像素点,而区域4中的点Ch1和Ch2的灰度值都很低,即背景。共定位越高,像素点越集中于斜率等于1的直线附近。通过散点图可以对共定位情况有一个直观的了解[14]。
|
图 5 散点图 Fig.5 Scatter diagram |
然后,由于各区域的界限需要人为设置,因此需要定义出图像中哪些像素点只含有单色荧光,以设定散点图中区域1和区域2的范围。
以图 2的A549细胞为例,如果图像中有肉眼可识别的只含有Ch1或Ch2信号的区域,可以利用这些区域来定义单通道荧光的阈值[14]。在Colocalization视图控制界面最上排的形状工具中,选择适当的形状(如矩形),在图像中选择只含有Ch1信号的区域。此时,由于散点图中只显示感兴趣区域中的像素点,所有的点都集中在Y轴附近。用鼠标拖曳Vertical下拉菜单右侧的滚动条,调节散点图中十字线横轴的位置,使区域2恰好包含当前散点图中显示的所有点(图 6)。然后,使用选择工具,将感兴趣区域移动到只含有Ch2信号的区域。同样地,此时散点图中所有的点都集中在X轴附近。用鼠标拖曳Horizontal下拉菜单右侧的滚动条,调节散点图中十字线纵轴的位置,使区域1恰好包含当前散点图中显示的所有点。这样,Ch1和Ch2单通道荧光的阈值就定义好了(图 4)。
|
图 6 Ch1阈值的定义 Fig.6 Threshhold of Ch1 |
点击选择工具右侧的Delete按钮,从图像中删除选中的感兴趣区域,软件会自动计算出整幅图像的荧光共定位效率。如果选中其中的某一个感兴趣区域,则Coloc表格中列出该区域的共定位情况。如果图像中同时存在多个感兴趣区域,Coloc表格中将逐一列出所有感兴趣区域的数据。在Delete按钮右侧的下拉菜单中,可以分别设定感兴趣区域边框的线条粗细和颜色。
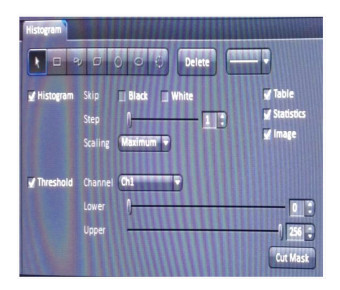
如果图像中没有容易识别的只含有Ch1或Ch2信号的区域,以图 3的HepG2细胞为例,则建议使用单独标记的对照样品来分别设定2个通道的阈值。需要准备2个单标的样品和实验组样品,用同样的拍照参数得到3张图片。在软件的Histogram模块中进行背景和信号的划分,利用其中的Threshold来分割荧光的信号和背景(图 7)。
|
图 7 Histogram视图控制界面 Fig.7 Histogram option control block |
常见问题:对共定位的评价方法不了解,不清楚这些方法分别表示什么意思。
衡量共定位程度有多种评价方法,以下以图 2中A549细胞的共定位数据为例,介绍常用的几种公式[15-17]:
(1) 皮尔森相关系数(Pearson’s correlation coefficient)
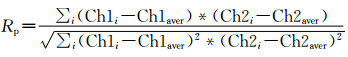
|
(1) |
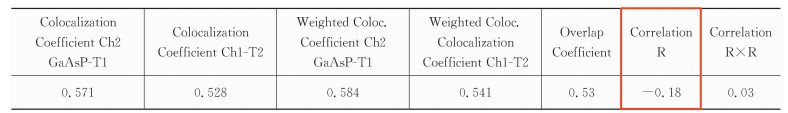
式(1)中的皮尔森相关系数Rp描述了图像与荧光强度有关的相关系数,即红的变亮,绿的也变亮,这就形成一个正相关,如红色通道荧光值是下降的,绿色通道是上升的,即呈负相关。数值范围为-1~+1,-1表明完全负相关,0表明没有显著的共定位。表 1中的Correlation R值即是皮尔森相关系数。
| 表 1 共定位数据Correlation R Table 1 Correlation R of colocalization data |
(2) Manders相关系数(Manders’ correlation coefficient)
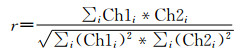
|
(2) |
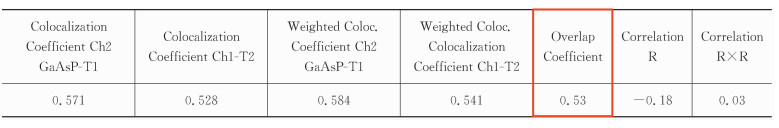
式(2)中的Manders相关系数r对图像分析中的荧光强度变化不敏感,只是亮度分布的一个系数。数值范围介于0和1之间。0代表没有共定位,1代表完全共定位。表 2中的Overlap coefficient值即Manders相关系数。
| 表 2 共定位数据Overlap coefficient Table 2 Overlap coefficient of colocalization data |
(3) 共定位系数(Colocalization coefficient)
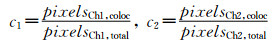
|
(3) |
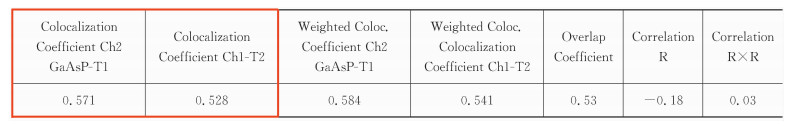
式(3)中的共定位系数c1和c2表述了两通道之间分别的共定位关系。数值范围0~+1,0表示无共定位关系,1表示完全共定位。举例说明:如c1为1,c2为0.3,则表示所有的红色都与绿色共定位,但只有30%的绿色与红色共定位。
表 3中红框圈出的前两项即共定位系数。
| 表 3 共定位数据Colocalization coefficient Table 3 Colocalization coefficient of colocalization data |
(4) 权重共定位系数(Weighted colocalization coefficient)
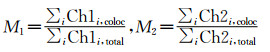
|
(4) |
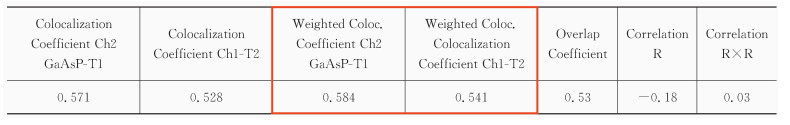
公式(4)的权重共定位系数M1和M2与公式(3)的共定位系数类似,但与荧光强度有关。数值范围0~+1,0表示无共定位关系,1表示完全共定位。较亮的荧光像素点对最终结果的影响更大。
表 4中红框标出的两项为权重共定位系数。
| 表 4 共定位数据Weighted colocalization coefficient Table 4 Weighted colocalization coefficient of colocalization data |
常见问题:不清楚这些系数代表共定位或无共定位的数值范围。
对于共定位的结果判定,可以参考Zinchuk等[16, 17]的文章,见表 5。图 3中标出的感兴趣细胞的Correlation R值为0.90,Overlap coefficient值为0.95,c1和c2分别为0.878和0.867,M1和M2分别为0.931和0.938,这些数据都说明了该细胞的共定位程度较高。
| 表 5 共定位结果判定 Table 5 Estimate colocalization |
本文对共定位研究过程中每个环节可能出现的问题做了分析,并为研究者提供了相应的办法。在实际工作中,使用Zeiss LSM880仪器进行共定位研究时,只要严格按照共定位实验的基本要求拍摄图像,并参考上述方法进行分析,避免出现以上常见问题,便可得到准确可靠的共定位分析结果。
| [1] |
刘继红, 汪成楚. 激光扫描共聚焦显微技术实验教学的思考[J]. 实验技术与管理, 2006, 23(1): 86–87.
Liu J H, Wang C C. Thought of laser scanning confocal microscopy experiment teaching[J]. Experimental Technology and Management, 2006, 23(1): 86–87. DOI:10.3969/j.issn.1002-4956.2006.01.031 |
| [2] |
李琳, 刘德旺, 田野. 激光共聚焦显微镜技术在中药研究中的应用[J]. 中成药, 2017, 39(5): 1038–1041.
Li L, Liu D W, Tian Y. Future prospects of confocal laser scanning microscopy in taditional chinese medicine[J]. Chinese Tmditional Patent Medicine, 2017, 39(5): 1038–1041. |
| [3] |
李叶, 黄华平, 林培群, 崔艳梅, 李勤奋, 郑勇奇. 激光扫描共聚焦显微镜的基本原理及其使用技巧[J]. 电子显微学报, 2015, 34(2): 169–176.
Li Y, Huang H, Lin P Q, Cui Y M, Li Q F, Zheng Y Q. The fundamentals and techniques in laser scanning confocal microscopy[J]. Journal of Chinese Electron Microscopy Society, 2015, 34(2): 169–176. DOI:10.3969/j.issn.1000-6281.2015.02.016 |
| [4] |
岳磊, 张垚, 马卓. 激光扫描共聚焦显微镜实验技术与应用[J]. 哈尔滨商业大学学报(自然科学版), 2015, 31(3): 263–266.
Yue L, Zhang Y, Ma Z. Technique and application skills of laser scanning confocal microscopy[J]. Journal of Harbin University of Commerce (Natural Sciences Edition), 2015, 31(3): 263–266. DOI:10.3969/j.issn.1672-0946.2015.03.003 |
| [5] |
王静, 李辉. 激光扫描共聚焦显微镜在脑部医学成像中的应用[J]. 激光杂志, 2016, 37(10): 102–105.
Wang J, Li H. Laser scanning confocal microscope used in medical imaging of the brain[J]. Laser Journal, 2016, 37(10): 102–105. |
| [6] |
段妍, 关苑君, 蓝秀健, 张选红, 吴珏珩. ZeissLSM710激光扫描共聚焦显微镜的使用和管理[J]. 实验室研究与探索, 2012, 31(8): 228–230, 239.
Duan Y, Guan Y J, Lan X J, Zhang X H, Wu J H. Use and management of laser scanning confocal microscopy Zeiss LSM 710[J]. Research and Exploration in Laboratory, 2012, 31(8): 228–230, 239. |
| [7] |
许佳玲, 王晓红, 罗剑文, 龙钊, 陈云凤, 张以顺. 蔡司LSM 7DUO NLO激光共聚焦显微镜的应用和管理[J]. 实验室研究与探索, 2017, 36(6): 281–285.
Xu J L, Wang X H, Luo J W, Long Z, Chen Y F, Zhang Y S. Application and administration of laser scanning confocal microscopy Zeiss LSM 7DUO NLO[J]. Research and Exploration in Laboratory, 2017, 36(6): 281–285. DOI:10.3969/j.issn.1006-7167.2017.06.066 |
| [8] |
孙学俊, 闫喜中, 郝赤. 激光共聚焦扫描显微镜技术简介及其应用[J]. 山西农业大学学报(自然科学版), 2016, 36(1): 1–14.
Sun X J, Yan X Z, Hao C. Confocal laser scanning microscopy, a general guideline and its applications[J]. Journal of Shanxi Agricultural University (Natural Sciences Edition), 2016, 36(1): 1–14. DOI:10.3969/j.issn.1671-8151.2016.01.001 |
| [9] |
Pastorek L, Sobol M, Hoz |
| [10] |
Ellen C. Technical Review:colocalization of antibodies using confocal microscopy[J]. The Anatomical Record, 2014, 297: 183–187.
DOI:10.1002/ar.v297.2 |
| [11] |
何薇, 耿慧武, 左恒, 阮操, 潘林鑫, 范礼斌, 刘晓颖. FK506结合蛋白25及其突变体与CLIC1蛋白在真核细胞内共定位的研究[J]. 安徽医科大学学报, 2016, 51(10): 1391–1395.
He W, Gen H W, Zuo H, Ruan C, Pan L X, Fan L B, Liu X Y. The co-localization of FKBP25 and its deletion mutants with CLIC1[J]. Acta Universitatis Medicinalis Anhui, 2016, 51(10): 1391–1395. |
| [12] |
于海波, 李红玲, 张新富, 肖义, 方沛菊, 吕春娇, 侯伟. 基于Nile Red的线粒体靶向性增强型硫化氢荧光探针及其细胞成像[J]. 化学学报, 2015, 73: 450–456.
Yu H B, Li H L, Zhang X F, Xiao Y, Fang P J, Lv C J, Hou W. A mitochondrial-targetable and turn-on fluorescent probe based on nile red and monitoring for H2S in living cells[J]. Acta Chimica Sinica, 2015, 73: 450–456. |
| [13] |
姚远, 冯姝婷, 赵鸿梅, 李艳. 雌激素受体alpha和肿瘤转移相关因子1在胃癌细胞中的表达和共定位[J]. 吉林大学学报(医学版), 2013, 39(1): 5–7.
Yao Y, Feng S T, Zhao H M, Li Y. Expressions and co-localization of ERα and MTA1 in gastric cancer cells[J]. Journal of Jilin University (Medicine Edition), 2013, 39(1): 5–7. |
| [14] |
王玥.LSM 710/780 brief manual[R]. Zeiss, 2015: 35-37.
Wang Y. LSM 710/780 brief manual[R].Zeiss, 2015: 35-37. |
| [15] |
Wu Y, Zinchuk V, Zinchuk O. Critical evaluation of quantitative colocalization analysis in confocal fluorescence microscopy[J]. Interdisciplinary Sciences-Computational Life Sciences, 2012, 4: 27–37.
DOI:10.1007/s12539-012-0117-x |
| [16] |
Zinchuk V, Zinchuk O, Okada T. Quantitative colocalization analysis of multicolor confocal immunofluorescence microscopy images:pushing pixels to explore biological phenomena[J]. Acta Histochemica Et Cytochemica, 2007, 40(4): 101–111.
DOI:10.1267/ahc.07002 |
| [17] |
Zinchuk V, Zinchuk O. Recent advances in quantitative colocalization analysis:focus on neuroscience[J]. Progress in Histochemistry and Cytochemistry, 2009, 44: 125–172.
DOI:10.1016/j.proghi.2009.03.001 |