水性涂料具有绿色环保的优点,以及低粘度、容易施工等特点[1-3],因而得到越来越广泛的应用。特别是水性可光固化聚氨酯(UV-WPU),成为最受瞩目的水性涂料之一。UV-WPU的高分子链上带有亲水基团,不需要使用外加的小分子乳化剂,可以在紫外光辐照下进行快速固化,固化膜具有较高的交联密度和优异的耐刮擦性和机械性能[4-7]。
UV-WPU通常是由二异氰酸酯与二元醇的聚加成反应得到。使用聚酯或聚醚二元醇引入软段;使用1.4-丁二醇或乙二醇引入硬段;双羟甲基丙酸或双羟甲基丁酸引入亲水基团;最后通常用2-羟乙基丙烯酸酯(HEA)引入光聚合基团[8-10]。Lee等[8]使用聚四氢呋喃二元醇、双羟甲基丁酸、环己烷甲基二异氰酸酯、苯均四酸二酐和HEA为原料,制备的UV-WPU固化膜表现出良好的机械性能和热稳定性。Yang等[11]将合成的多官能团巯基化合物与多官能团双键化合物混合,制得一系列可光聚合的聚氨酯水分散体,表现出良好的溶解性、稳定性,以及较高的聚合物速率。Kim等[12]制备了用于阳离子电沉积的可光固化聚氨酯乳液,中和后的聚氨酯水分散体与季戊四醇三丙烯酸酯具有良好的混溶性,没有相分离现象,并具有很高的聚合速率,固化膜具有良好的耐溶剂性。
但目前这些常用方法都有一定的局限性。当聚氨酯预聚体的分子量增大后,粘度会急剧上升,二异氰酸酯的反应活性大大下降,因而在反应后期,只能靠提高反应温度并延长反应时间来获得较高的转化率,然而这极易导致丙烯酸酯的自聚,使整个体系发生凝胶,难以抑制的丙烯酸酯自聚是该合成路线中最大的挑战。此外,用来引入光固化基团的HEA是单羟基化合物,与聚氨酯预聚体反应后无法再继续进行聚加成反应,导致所得聚氨酯树脂的丙烯酸酯基团含量有限,降低固化膜的交联密度,从而影响到机械性能和其他方面的性质。
巯基-迈克尔加成和巯基-异氰酸酯反应因具有反应高效、条件温和、产率高等优点被称为“点击化学”[13-17]。本研究使用巯基-迈克尔加成和巯基-异氰酸酯反应来合成可光固化的硫代聚氨酯水分散体。硫醚和硫代聚氨酯分别是巯基-迈克尔和巯基-异氰酸酯反应的产物,硫醚键相对柔软[18],而硫代聚氨酯与聚氨酯类似,含有氢键,刚性较强[19]。因此,我们设想,可以使用柔软的硫醚键作为光固化水性分散体的软段,刚性的硫代聚氨酯作为硬段。
我们先合成了一种二丙烯酸酯-单甲基丙烯酸酯单体,二异氰酸酯在室温下与过量的二硫醇进行巯基-异氰酸酯反应,然后与二丙烯酸酯单体进行巯基-迈克尔加成。由于丙烯酸酯的活性比甲基丙烯酸酯高,二丙烯酸酯-单甲基丙烯酸酯单体可以与二巯基化合物进行选择性反应,甲基丙烯酸酯留在聚合物链的侧基上。这种方法不仅具有反应高效、转化率高、条件温和的优点,而且可有效提高光固化官能团的含量,也可以方便地调节树脂的结构和固化膜的性能。
1 实验部分 1.1 试剂与仪器试剂:1, 6-己二醇二丙烯酸酯(HDDA)、三乙胺(TEA)、二氯甲烷(DCM)、乙酸乙酯、正己烷、无水硫酸镁、碳酸氢钠,购于上海阿拉丁生化科技股份有限公司;丙烯酰氯(AC)、2-巯基乙酸(MAA)、异氟尔酮二异氰酸酯(IPDI)、乙二醇二(3-巯基丙酸)酯(GDMP)、3-(丙烯酰氧基)-2-羟丙基甲基丙烯酸酯(AHPMA)、丙酮,购于Fisher Scientific;2-甲基-2-羟基-1-苯基丙酮(Irgacure 1173)由天津久日新材料股份有限公司提供。除丙酮用活化的4A分子筛干燥过夜,其他试剂均直接使用。
仪器:所有NMR图谱均使用Bruker Avance-Ⅲ 400在25 ℃下记录,以氘代氯仿作为溶剂(δ= 7.26 ppm)。FT-IR用Nicolet 750 Magna红外分光光度计测量,样品置于两块NaCl晶片之间,分别在2568 cm-1和2270 cm-1处观察巯基和异氰酸酯的信号峰。用Nicolet 750 Magna FT-IR spectrometer记录光聚合动力学,测试时,将样品加载两块玻璃片之间,置于垂直透射装置中[20],通过监控6167 cm-1处的峰面积计算不饱和双键的转化率[21]。
固化膜的拉伸储能模量和损耗因子使用动态热力学分析仪记录(DMA Q800, TA Instruments, USA),测试频率为1 Hz,升温速率为3 ℃/min。玻璃化转变温度(Tg)定义为损耗因子(tanδ)最大值所对应的温度。凝胶渗透色谱GPC(Waters 2414)测定聚合物的分子量和分子量分布,溶剂为四氢呋喃,流速0.5 mL/min,使用聚苯乙烯作为标样。乳液的平均粒径使用动态光散射仪(Malvern Zetasizer Nanao ZS90)在25 ℃下测定。使用QHQ-A铅笔硬度计(中国天津)来测试固化膜的硬度。
1.2 实验步骤 1.2.1 合成3-(甲基丙烯酰氧基)丙基-1, 2-二丙烯酸酯(MAPDA)3-(丙烯酰氧基)-2-羟丙基甲基丙烯酸酯(AHPMA)(10 g,0.0467 mol)和TEA(4.96 g, 0.049 mol)同时溶于70 mL DCM,置于冰水浴中。丙烯酸氯(4.44 g, 0.049 mol)溶于20 mL DCM,然后在1 h内滴加到AHPMA中,并在室温下反应过夜。过滤除去三乙胺盐酸盐,将反应物用饱和碳酸氢钠溶液洗涤3次(3×60 mL),用无水硫酸镁干燥有机相约5 h,然后过滤,用旋转蒸发仪除去二氯甲烷。将得到的粗产物用柱色谱纯化,洗脱剂为乙酸乙酯/正己烷(1/9),得到粘稠透明液体,即为最终产物3-(甲基丙烯酰氧基)丙基-1, 2-二丙烯酸酯(MAPDA), 8.9 g,产率71%。
1HNMR(CDCl3, 400 MHz):6.44 (m, 2H, CH2=CH—), 6.17~6.08 (m, 3H, CH2=C(CH3)—, CH2=CH—), 5.88 (m, 2H, CH2=CH—), 5.59 (1H, CH2=C(CH3)—), 5.45(m, 1H, —CH2—CH(OOCCH=CH2)—CH2—), 4.46~4.28(m, 4H, —CH2—CH(OOCCH=CH2) —CH2—), 1.93 (s, 3H, CH2=C(CH3)—)。
13CNMR(CDCl3, 100 MHz):166.75(CH2=C(CH3)—CO—O—), 165.32(CH2=CH—CO—O—), 135.64(CH2=C(CH3)—CO—O—), 131.71 (CH2=CH—CO—O—), 127.76(CH2=CH—CO—O—), 126.39(CH2=C(CH3)—CO—O—), 69.14(—CH2—CH(OOCCH=CH2)—CH2—), 62.49(—CH2—CH(OOCCH=CH2)—CH2—),18.22(CH3=C(CH3)—CO—O—)。
1.2.2 合成可光固化硫代聚氨酯水分散体(WPTU)在冰水浴条件下,将IPDI在1.5 h内缓慢滴加到GDMP、TEA(1%,质量分数)的丙酮(50 mL)溶液中,在室温下反应直至红外谱图中2270 cm-1处异氰酸酯的信号峰完全消失,得到硫代聚氨酯二巯基化合物低聚物(PTDT);然后,将上述溶液缓慢滴加到含有MAPDA和HDDA的圆底烧瓶中,使用机械搅拌,在室温下进行巯基-迈克尔加成反应,直至巯基的特征峰(2568 cm-1)完全消失,得到甲基丙烯酸酯化的硫代聚氨酯(PTMA)。最后,将MAA加入上述反应液中,直至巯基的特征峰(2568 cm-1)完全消失。剧烈搅拌,将产物分散在水中,即得到可光固化硫代聚氨酯水分散体(WPTU),合成路线如图 1所示。
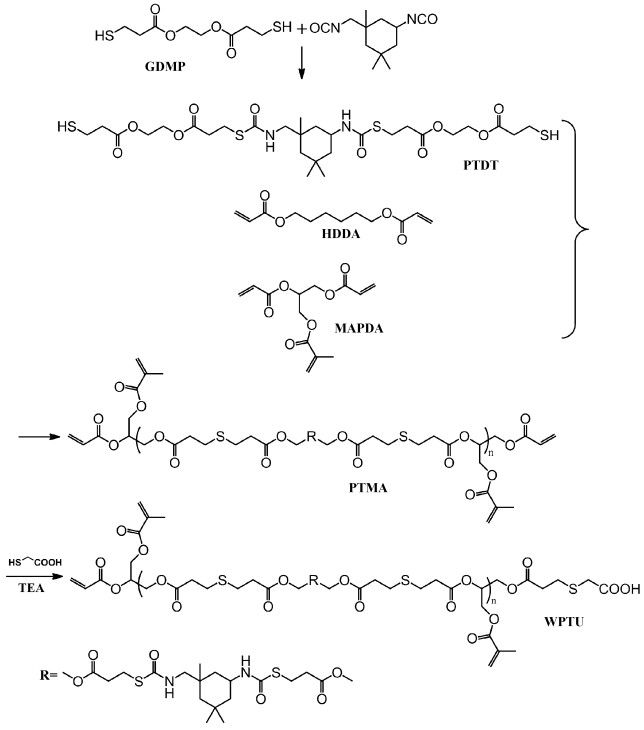
|
图 1 可光固化硫代聚氨酯水分散体(WPTU)的合成路线 Schematic illustration for the synthesis of WPTU |
改变GDMP、IPDI、MAPDA、HDDA和MAA的摩尔比,可以得到一系列不同双键和硫代聚氨酯含量的样品(表 1、表 2)。为了研究不饱和双键和异氰酸酯含量对WPTU固化膜的影响,我们分别制备了两个系列的WPTU,系列1(WPTU-1)的不饱和双键含量保持恒定,而异氰酸酯含量从0改变到2.93 mmol/g;系列2(WPTU-2)的异氰酸酯含量保持恒定,不饱和双键含量从1.21 mmol/g降至0.204 mmol/g,由表 2可知WPTU的粒径介于50~100 nm,固含量为20%~30%(质量分数),都在相对合理的范围内,见表 2。
| 表 1 WPTU的投料比例 Compositions of UV-curable waterborne polythiourethane (WPTU) |
| 表 2 WPTU的双键含量、异氰酸酯含量、粒径和固含量 Double bond content, isocyanate content, particle size and solid content of WPTU |
WPTU-1-3的1HNMR(CDCl3, 400 MHz):6.43~6.38(CH2=CH—), 6.16~6.09 (CH2=C(CH3)—, CH2=CH2—), 5.85~5.81(CH2=CH—), 5.62(CH2=C(CH3)—), 5.35(—CH2—CH(OOCCH=CH2)—CH2—), 4.33~4.08(—COO—CH2—), 3.19~3.12(—CO—S—CH2—), 2.83~2.59 (—CH2—S—CH2—, —CH2—COO—), 1.94(CH2=C(CH3)—), 1.42~0.91 (—CH2—CH2—)。
WPTU-1-3的FT-IR (NaCl盐片, cm-1): 3350(—NH—CO—S—的N—H伸缩振动), 2955和2865(—CH2—CH2—的C—H伸缩振动), 1738(酯键和硫代氨酯键中的C=O伸缩振动), 1520(—NH—CO—S—的N—H弯曲振动), 813 (CH2=C(CH3)—COO—和CH2=CH—COO—的C—H旋转振动)。
1.2.3 样品制备将合成的WPTU与2% (质量分数)1173混合,在室温下搅拌2 h,得到均一乳液;然后用涂抹器涂在玻璃片上,置于70 ℃烘箱中挥发水分,直至质量达到恒定值;再将另一块玻璃片覆盖在样品表面,同时将厚度为250 μm的塑料片放在两块玻璃片之间。
测量光聚合动力学,将样品放置在装配有水平透射装置的红外光谱仪上,用紫外光(Acticure 4000, EXFO, Quebec City, Canada)辐照10 min,波长范围为320~390 nm, 光强为30 mW/cm2。将固化后的样品切成尺寸为8 mm× 4 mm × 0.25 mm的长条形,用于DMA测试。
2 结果与讨论 2.1 MAPDA的1HNMR和13CNMR图谱用TEA作为缚酸剂,AHPMA与丙烯酸氯酯化反应合成MAPDA(图 2)。MAPDA的1HNMR和13CNMR如图 3所示,6.44、5.88处的吸收峰归属于丙烯酸酯双键上的氢原子;5.59处为甲基丙烯酸酯双键中氢原子的信号峰;6.17~6.08是丙烯酸酯和甲基丙烯酸酯双键氢原子的重叠峰;5.45、4.46~4.28归属于酯键旁边的次甲基和亚甲基;1.93处是甲基丙烯酸酯的甲基特征吸收峰。
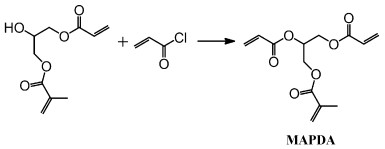
|
图 2 3-(甲基丙烯酰氧基)丙基-1, 2-二丙烯酸酯(MAPDA)的合成 Synthesis route of 3-(methacryloyloxy)propane-1, 2-diyl diacrylate (MAPDA) |
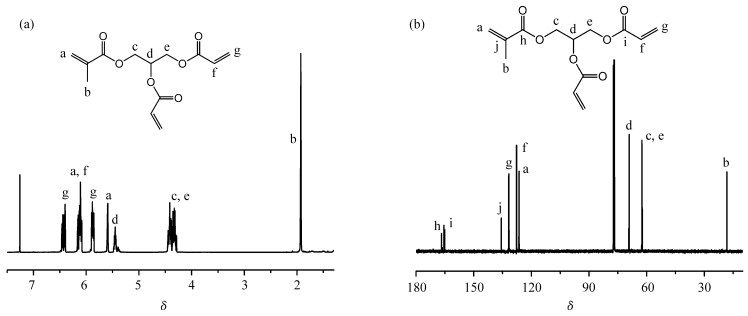
|
图 3 MAPDA在溶剂CDCl3中的(a)1HNMR谱图和(b)13CNMR谱图 (a) 1HNMR and (b) 13CNMR spectra of 3-(methacryloyloxy)propane-1, 2-diyl diacrylate (MAPDA) in CDCl3 |
图 3(b)为MAPDA的13CNMR图谱,166.75、165.32处是羰基上碳原子的信号峰;135.64、126.39、18.22处是CH2=C(CH3)—上的碳原子共振吸收峰;131.71、127.76归属于CH2=CH—上的碳原子。
2.2 WPTU的红外谱图、1HNMR谱图、GPC曲线、粒径和固含量GDMP和IPDI在TEA的催化下,进行巯基-异氰酸酯“点击”反应,可以看到异氰酸酯完全参与反应;同时,可以看到3350 cm-1处的硫代氨基甲酸酯特征峰和2568 cm-1处巯基的吸收峰,如图 4(a)所示。将PTDT加入MAPDA和HDDA中,在同一条件下进行巯基-迈克尔加成反应(图 1)。相比于甲基丙烯酸酯,丙烯酸酯双键的吸电子效应更强、位阻更小,因此其反应活性更强[13, 15]。所以,MAPDA上的甲基丙烯酸酯几乎不会与巯基反应,而是留在聚合物的侧基上。当反应完成后,2568 cm-1处的巯基特征峰完全消失,但在813 cm-1处可以看到丙烯酸酯和甲基丙烯酸酯上的C—H弯曲振动吸收峰,见图 4(b)。为了在聚合物主链中引入亲水基团,随后加入MAA继续进行巯基-迈克尔加成反应。由于MAA的含量很少(2.5%,质量分数),WPTU的红外谱图与PTMA几乎完全相同,见图 4(c)。
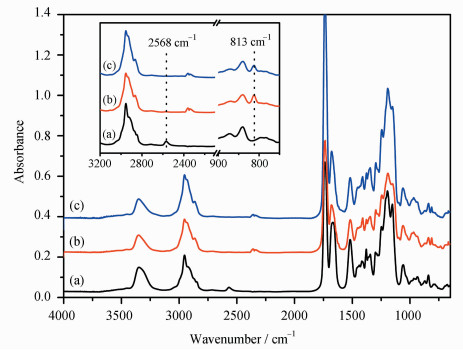
|
图 4 (a) 硫代聚氨酯二巯基化合物低聚物(PTDT)的FTIR谱图;(b)甲基丙烯酸酯化的硫代聚氨酯(PTMA)的FTIR谱图;(c)可光固化硫代聚氨酯水分散体(WPTU)的FTIR谱图 FTIR spectra of (a) oligomer polythiourethane dithiol (PTDT), (b) polythiourethane methacrylate (PTMA) and (c) waterborne polythiourethane (WPTU) |
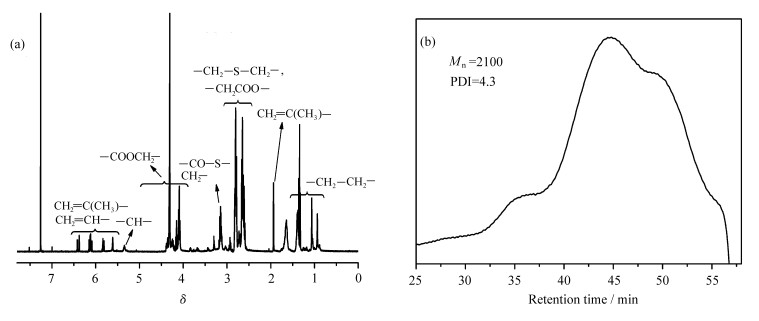
WPTU-1-3的1HNMR谱图如图 5(a)所示,6.43~5.61是丙烯酸酯和甲基丙烯酸酯上双键的特征吸收峰,4.33~4.08、2.83~2.59分别是酯键和硫醚键旁边亚甲基的信号峰。为了防止羧基化合物吸附在凝胶色谱柱上(GPC),我们使用PTMA代替WPTU来测试聚合物的分子量,PTMA与MAA反应后得到WPTU,二者的分子量不会有太大差别。通过GPC得知,WPTU-1-3的数均分子量为2100,多分散指数(PDI)为4.4,如图 5(b)所示。
|
图 5 WPTU-1-3的(a)1HNMR谱图和(b)GPC曲线图 (a) 1HNMR spectrum of WPTU-1-3 in CDCl3; (b) THF GPC trace of WPTU-1-3 |
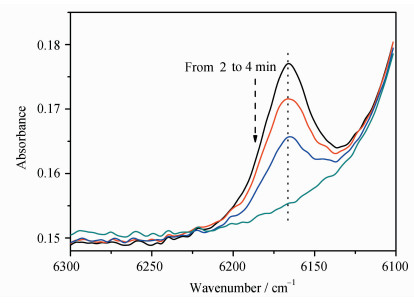
利用实时红外(RT-FTIR)研究了WPTU树脂的光聚合动力学。将样品与2%(质量分数)的1173充分混合,将水分挥发干,保持2 min后,打开紫外灯(320~390 nm,30 mW/cm2)开始辐照。通过监控不饱和双键特征峰(6167 cm-1)的峰面积减少来计算转化率,如图 6所示。可以看到,在2~4 min内,6167 cm-1的峰面积持续减小。
|
图 6 WPTU-1-1的实时红外(RT-FTIR)曲线图 RT-FTIR spectra of photopolymerization process of WPTU-1-1 |
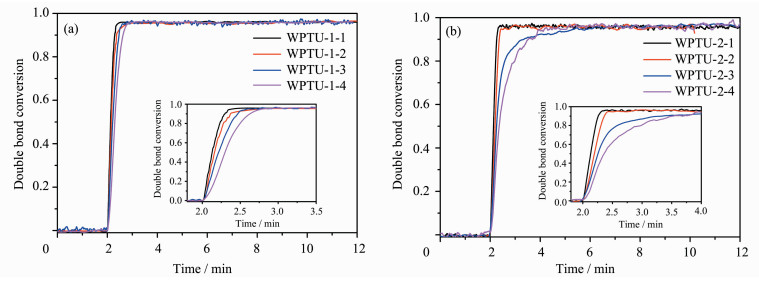
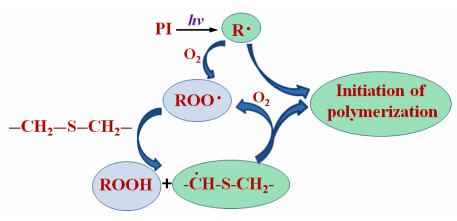
如图 7(a)所示,WPTU-1-1在UV光照1 min内的转化率迅速达到95.8%,而WPTU-1-2、WPTU-1-3、WPTU-1-4的转化率曲线均比较类似,也迅速达到了96%左右;同时,聚合速率随着硫代氨基甲酸酯含量的减少而降低,这可能是由于粘度的不同造成的。如图 7(b)所示,WPTU-2-1在UV光照1 min内的转化率迅速达到96.1%;WPTU-2-2、WPTU-2-3、WPTU-2-4聚合速率随着双键含量的减少而降低,但最终转化率均在96%左右。WPTU之所以表现出如此高的转化率和较快的聚合速率,可能是因为聚合物主链中含有的硫醚键可以有效克服氧阻聚效应[22, 23],如图 8所示。初始自由基或大分子自由基可以很快与氧气分子反应,生成没有引发活性的过氧自由基,然而过氧自由基可以夺取硫醚键α-C上的氢原子,生成一个新自由基,继续引发不饱和双键的聚合反应。
|
图 7 WPTU的光聚合动力学曲线 (a) WPTU-1; (b) WPTU-2 Photopolymerization kinetics of WPTU |
|
图 8 硫醚克服氧阻聚效应的机理示意图 Elimination of oxygen inhibition effect by thioether group |
用DMA测定WPTU固化膜的玻璃化转变温度(Tg)和交联密度(Ve)。基于橡胶弹性理论计算得到交联密度,橡胶态下的弹性模量(E′)与交联密度(Ve)之间的关系如式1所示[24]。
|
(1) |
式中,Ve为交联密度,E′为橡胶态下的弹性模量(取T=Tg+30 ℃),T为开氏温度,R为理想气体常数。
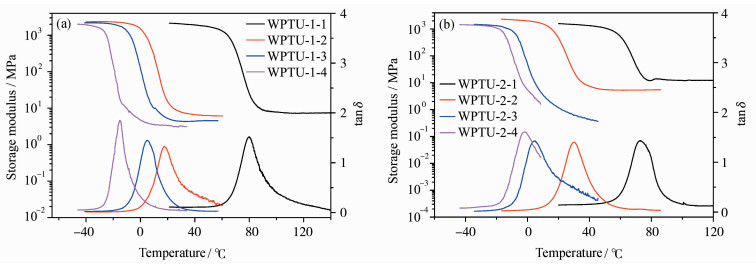
随着不饱和双键和异氰酸酯含量的增加,Tg和Ve也随之变大。这可以简单理解为不饱和双键聚合后形成交联点,双键含量越高,交联密度也会越大。另一方面,异氰酸酯与巯基反应后生成硫代氨基甲酸酯,由于—NH—与羰基之间的氢键作用,会形成物理交联,因而也会提高聚合物网络整体的交联密度[25]。因此,在WPTU中引入的不饱和双键或硫代氨基甲酸酯越多,固化膜的交联密度就越高,Tg也就越高,如图 9和表 3所示。此外,测量了固化膜的铅笔硬度,结果列于表 3。
|
图 9 WPTU固化膜的动态热力学曲线 DMA curves of the UV cured WPTU films (a) WPTU-1;(b) WPTU-2 |
| 表 3 WPTU光固化膜的双键转化率、玻璃化转变温度(Tg)、交联密度(Ve)和铅笔硬度 Double bond conversion, Tg, Ve, and pencil hardness of UV cured WPTU films |
随着不饱和双键或硫代氨基甲酸酯含量的增加,固化膜的硬度有显著提高,最高达到2H,这也是固化膜交联密度增加的结果。
3 结论我们用“一锅连续”法合成了一系列可光固化硫代聚氨酯水分散体,巯基-异氰酸酯和巯基-迈克尔加成反应都具有反应效率高、条件温和、产率高的优点。IPDI先与过量的GDMP进行巯基-异氰酸酯反应,得到硫代聚氨酯二巯基化合物(PTDT),然后与HDDA、MAPDA和MAA进行巯基-迈克尔加成反应,得侧基为甲基丙烯酸酯的预聚体,分散入水后得到可光固化硫代聚氨酯水分散体。
由于丙烯酸酯比甲基丙烯酸酯的活性高,聚合物主链上含有很多可光聚合的甲基丙烯酸酯基团,显著提高了固化膜的交联密度。固化膜表现出良好的机械性能,Tg和铅笔硬度的最高值分别达到80 ℃和2H。这是第一个使用连续的巯基-点击化学合成可光固化硫代聚氨酯水分散体的例子,我们也因此相信,巯基-X点击化学在合成高性能涂料中将具有更大的发展潜力和更广泛的应用。
| [1] |
Weiss K D. Paint and coatings: a mature industry in transition[J]. Progress in Polymer Science, 1997, 22: 203-245. DOI:10.1016/S0079-6700(96)00019-6 |
| [2] |
Glass J E. Technology for waterborne coatings[C].American Chemical Society, 1997.
|
| [3] |
Wicks F N J, Pappas S P, Wicks D A. Organic Coatings: Science and Technology[M]. 3rd Edition. Waterborne Coatings: John Wiley & Sons, Inc, 2006.
|
| [4] |
Van den Berg K J, Van der Ven L G J, Van den Haak H J W. Development of waterborne UV-A curable clear coat for car refinishes[J]. Progress in Organic Coatings, 2008, 61: 110-118. DOI:10.1016/j.porgcoat.2007.09.037 |
| [5] |
Meng Q B, Lee S I, Nah C, Lee Y S. Preparation of waterborne polyurethanes using an amphiphilic diol for breathable waterproof textile coatings[J]. Progress in Organic Coatings, 2009, 66: 382-386. DOI:10.1016/j.porgcoat.2009.08.016 |
| [6] |
Chattopadhyay D K, Raju K V S N. Structural engineering of polyurethane coatings for high performance applications[J]. Progress in Polymer Science, 2007, 32: 352-418. DOI:10.1016/j.progpolymsci.2006.05.003 |
| [7] |
Bai C Y, Zhang X Y, Dai J B, Li W H. A new UV curable waterborne polyurethane: effect of CC content on the film properties[J]. Progress in Organic Coatings, 2006, 55: 291-295. DOI:10.1016/j.porgcoat.2005.12.002 |
| [8] |
Lee M H, Choi H Y, Jeong K Y, Lee J W, Hwang T W, Kim B K. High performance UV cured polyurethane dispersion[J]. Polymer Degradation and Stability, 2007, 92: 1677-1681. DOI:10.1016/j.polymdegradstab.2007.06.006 |
| [9] |
Masson F, Decker C, Jaworek T, Schwalm R. UV-radiation curing of waterbased urethane-acrylate coatings[J]. Progress in Organic Coatings, 2000, 39: 115-126. DOI:10.1016/S0300-9440(00)00128-4 |
| [10] |
Heischkel Y, Larbig H, Lebkucher W, Schwalm R, Gruber N, Kruger C, Kluge M, Dieleman C. Radiation-curable aqueous polyurethane dispersions[P].US patent, US 20080145563 A1. 2008.
|
| [11] |
Yang Z, Wicks D A, Hoyle C E, Pu H, Yuan J, Wan D, Liu Y. Newly UV-curable polyurethane coatings prepared by multifunctional thiol- and ene-terminated polyurethane aqueous dispersions mixtures: preparation and characterization[J]. Polymer, 2009, 50: 1717-1722. DOI:10.1016/j.polymer.2008.12.018 |
| [12] |
Kim Y B, Kim H K, Yoo J K, Hong J W. UV-curable polyurethane dispersion for cationic electrodeposition coating[J]. Surface and Coatings Technology, 2002, 157: 40-46. DOI:10.1016/S0257-8972(02)00133-0 |
| [13] |
Hoyle C E, Lee T Y, Roper T. Thiol-enes: chemistry of the past with promise for the future[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2004, 42: 5301-5338. DOI:10.1002/pola.20366 |
| [14] |
Hoyle C E, Lowe A B, Bowman C N. Thiol-click chemistry: a multifaceted toolbox for small molecule and polymer synthesis[J]. Chemical Society Reviews, 2010, 39: 1355-1387. DOI:10.1039/b901979k |
| [15] |
Nair D P, Podgórski M, Chatani S, Gong T, Xi W, Fenoli C R, Bowman C N. The thiol-michael addition click reaction: a powerful and widely used tool in materials chemistry[J]. Chemistry of Materials, 2014, 26: 724-744. DOI:10.1021/cm402180t |
| [16] |
Hensarling R M, Rahane S B, LeBlanc A P, Sparks B J, White E M, Locklin J, Patton D L. Thiol-isocyanate "click" reactions: rapid development of functional polymeric surfaces[J]. Polymer Chemistry, 2011, 2: 88-90. DOI:10.1039/C0PY00292E |
| [17] |
Li H, Yu B, Matsushima H, Hoyle C E, Lowe A B. The Thiol-isocyanate click reaction: facile and quantitative access to ω-end-functional poly(n, n-diethylacrylamide) synthesized by RAFT radical polymerization[J]. Macromolecules, 2009, 42: 6537-6542. DOI:10.1021/ma9010878 |
| [18] |
Guo R Y, Zhang J Z, Wu S H. Synthesise of polythioether and heat resistant property of polythioether sealants[J]. Procedia Engineering, 2015, 99: 1234-1240. DOI:10.1016/j.proeng.2014.12.653 |
| [19] |
Li Q, Zhou H, Wicks D A, Hoyle C E. Thiourethane-based thiol-ene high Tg networks: preparation, thermal, mechanical, and physical properties[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2007, 45: 5103-5111. DOI:10.1002/pola.22252 |
| [20] |
Trujillo M, Newman S M, Stansbury J W. Use of near-IR to monitor the influence of external heating on dental composite photopolymerization[J]. Dental Materials, 2004, 20: 766-777. DOI:10.1016/j.dental.2004.02.003 |
| [21] |
Stansbury J W, Dickens S H. Determination of double bond conversion in dental resins by near infrared spectroscopy[J]. Dental Materials, 2001, 17: 71-79. DOI:10.1016/S0109-5641(00)00062-2 |
| [22] |
Lee T Y, Kaung W, Jönsson E S, Lowery K, Guymon C A, Hoyle C E. Synthesis and photopolymerization of novel multifunctional vinyl esters[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2004, 42: 4424-4436. DOI:10.1002/pola.20181 |
| [23] |
Andrzejewska E, Andrzejewski M. Polymerization kinetics of photocurable acrylic resins[J]. Journal of Polymer Science Part A: Polymer Chemistry, 1998, 36: 665-673. |
| [24] |
Xie H, Hu L H, Zhang Y, Shi W F. Sulfur-containing hyperbranched polymeric photoinitiator end-capped with benzophenone and tertiary amine moieties prepared via simultaneous double thiol-ene click reactions used for UV curing coatings[J]. Progress in Organic Coatings, 2011, 72: 572-578. DOI:10.1016/j.porgcoat.2011.06.020 |
| [25] |
Li Q, Zhou H, Wicks D A, Hoyle C E, Magers D H, McAlexander H R. Comparison of small molecule and polymeric urethanes, thiourethanes, and dithiourethanes: hydrogen bonding and thermal, physical, and mechanical properties[J]. Macromolecules, 2009, 42: 1824-1833. DOI:10.1021/ma802848t |




