2. 太原理工大学 新材料界面科学与工程教育部重点实验室, 山西 太原 030024;
3. 山西医科大学第二医院 介入治疗科, 山西 太原 030001
2. Key Laboratory of Interface Science and Engineering in Advanced Materials, Ministry of Education, Taiyuan University of Technology, Taiyuan 030024, Shanxi, P. R. China;
3. Department of Interventional Therapy, Second Hospital of Shanxi Medical University, Taiyuan 030001, Shanxi, P. R. China
分子影像是在细胞及分子层面对生物过程的表征与监测技术[1]。目前单一分子影像技术已经在疾病诊断及治疗中普遍应用,如磁共振成像(MRI)、正电子发射断层成像术(PET)、单光子发射计算机断层成像术(SPECT)等,但其分辨率、灵敏度等需要改进。双模态分子探针是指将两种不同类型分子影像探针结合,使这两种成像方式同时用于疾病的诊断和治疗,不仅突破了单一分子影像技术的瓶颈,而且不同分子成像方式得以优势互补,最重要的是拓宽了分子影像技术在诊断及治疗等方面的研究范围和应用前景[2, 3],因此逐渐成为研究热点。目前,已有多种双模态分子探针诞生,如荧光-MRI探针、PET-MRI探针、PET-光学分子探针、超声-光学探针等。其中,荧光-MRI双模态分子探针由于具有优越的光学成像及高分辨结构组织成像特点,其研究进展及应用引人注目。
MRI具有软组织分辨率较高、多序列成像、无辐射危害、多参数等特点,对癌症的早期诊断有较大贡献,但其靶向性和灵敏度较低。虽然荧光成像灵敏度高,但其对软组织分辨率低,因此将荧光成像与MRI相结合,构建荧光-MRI双模态分子探针,既能提高软组织分辨率又能提高灵敏度[4],并且MRI还可以提供功能显像信息,例如波谱分析、扩散成像等。传统的荧光探针种类繁多,例如荧光碳量子点、半导体量子点、荧光硅点、金属纳米簇等,其中碳量子点(CDs)是一种荧光性能良好的生物荧光分子探针。与传统的有机荧光染料相比,CDs抗光漂白能力强、荧光稳定性高、激发及发射光谱宽且连续[5],并且具有低细胞毒性、表面易官能化、良好的生物相容性等优点,使其在双模态荧光分子探针方面具有广泛的应用前景。
钆掺杂碳量子点(Gd-CDs)是一种新型纳米颗粒,同时也是一种典型的荧光-MRI双模态分子探针。钆离子是一种具有强顺磁性的金属离子,其螯合物具有7个未配对电子,可产生强大的磁矩, 能明显缩短T1弛豫时间,这种独特的性质使其已广泛用于MRI造影剂[6-9]。Gd-CDs作为荧光探针和药物载体,将药物靶向运输到肿瘤,可提高治疗肿瘤的效果;同时通过荧光成像和MRI相结合的双模态影像检测技术,将肿瘤监测、诊断和治疗一体化,不仅可以实现肿瘤病程动态监测,也会减少对周围正常组织的毒副作用[10],这使其在肿瘤的靶向性成像及治疗领域具有较优越的应用潜力。
本文对Gd-CDs的合成、特性以及在双模态成像中的应用进行阐述,系统综述了Gd-CDs在肿瘤诊断和治疗中最新的应用研究,同时针对目前存在的问题,对未来研究进行展望。
1 Gd-CDs的合成CDs的制备分为自上而下法与自下而上法两种,目前文献报道Gd-CDs的合成方法多为自下而上法。自下而上法是指将含碳小分子物质进行炭化、高温来制备CDs的方法,这种方法可以更加有效地控制CDs的形状、大小[11]。Gd-CDs的合成方法有水热法、微波法和燃烧法等。钆离子以掺杂的方式与CDs结合,利于控制所得Gd-CDs的粒径,粒径较小的Gd-CDs双模态分子探针能够更容易地进入细胞并且更易于体内代谢,生物相容性较高。
1.1 水热法水热法是一种对CDs形状、尺寸、稳定性和表面组成可控性较强的合成方法,主要是指在反应釜高温高压的条件下,将小分子碳源及钆源加入到溶剂中制备产物的方法。水热法制得的CDs具有良好的荧光性能及较高的荧光量子产率[11]。并且水热法反应温度较低,可以避免钆离子在碳化过程中的损失。
袁雪霞等[12]以钆喷酸单葡胺为原料,采用一步水热反应制备CDs的前驱体。在此反应中,钆喷酸单葡胺同时作为钆源及碳源,且水溶性较好。一步水热法制备的Gd-CDs保证了双模态分子探针的整体性,得到的Gd-CDs平均尺寸仅1.60 nm,粒径分布在0.5~2.75 nm之间,粒度分布较窄,颗粒较均匀,这也是水热法的优势所在。Yu等[13]以柠檬酸及氯化钆为原料用水热法制备了Gd-CDs,如图 1所示,以柠檬酸为碳源的原因是其与其它无毒酸相比能提供更多的羧基,这些羧基在CDs形成过程中可螯合钆离子,同时大大提高荧光量子产率(高达69.86%)。
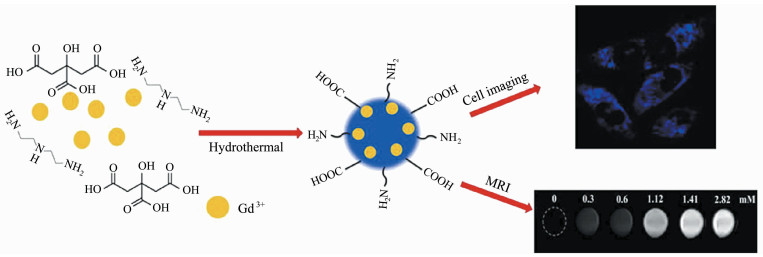
|
图 1 以柠檬酸及氯化钆为原料,通过水热法制备Gd-CDs的流程图[13] |
微波法是指以微波短时间加热使有机物碳化从而制备CDs的方法,它是一种耗时较短、操作简单、对仪器要求较低、更为经济和绿色的方法。Yao等[14]将柠檬酸选作碳源,氯化钆为钆源,聚乙烯亚胺(PEI)作为钝化剂,加入甘油中并充分混合溶解,微波加热可以快速制备深棕色的Gd-CDs,如图 2所示。该研究发现微波反应时间可影响碳源的碳化程度及Gd-CDs的粒径,可实现对产物的调控。Gong等[15]通过微波法制备了Gd-CDs,选用蔗糖溶液为碳源、氯化钆为钆源,其粒径大小约为5 nm,在高分辨透射电镜下观察晶格间距为0.334 nm,荧光量子产率为5.4%。
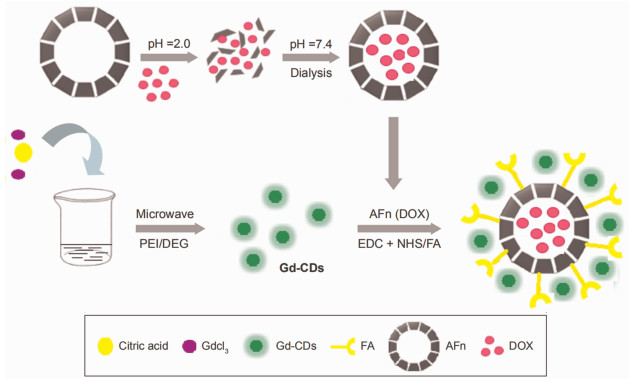
|
图 2 以微波法制备Gd-CDs的流程图[14] |
燃烧法是一种早期发现的在高温下获得CDs的方法。2014年,Chen等[16]采用燃烧法制备了Gd-CDs。实验中选用钆喷酸葡胺同时作为钆源及碳源,先将钆喷酸葡胺干燥成粉末,然后在空气中以300 ℃的温度燃烧2 h,最终获得碳壳包钆的结构;在高分辨透射电镜下Gd-CDs的形态为纳米球形,直径约为12 nm,尺寸分布相对较窄;荧光量子产率为19.7%,与一些文献报道的最高荧光量子产率接近。燃烧法操作步骤简单,原料成本低,但其操作不易控制,所得Gd-CDs颗粒荧光性质不太稳定[17]。
2 Gd-CDs的性能Gd-CDs由于具备优越的光学特性、磁学特性和良好的生物相容性,在生物成像、细胞标记和药物靶向运输等领域获得了极大关注。
2.1 光学特性Yao等[14]制备的Gd-CDs表现出上转换荧光特性,当激发波长为760~860 nm,上转换的发射波长蓝移至400~600 nm处,最大发射峰稳定在470 nm处。激发波长至红外波段有许多优势,如对生物体无较大伤害、有较强的光穿透性等。Xu等[18]得到的Gd-CDs紫外吸收峰在290 nm处出现(如图 3),证实由于n-π*的跃迁使得钆离子与CDs发生强相互作用;并且证实了在365 nm激发波长下,钆离子浓度越高,蓝色荧光越强。
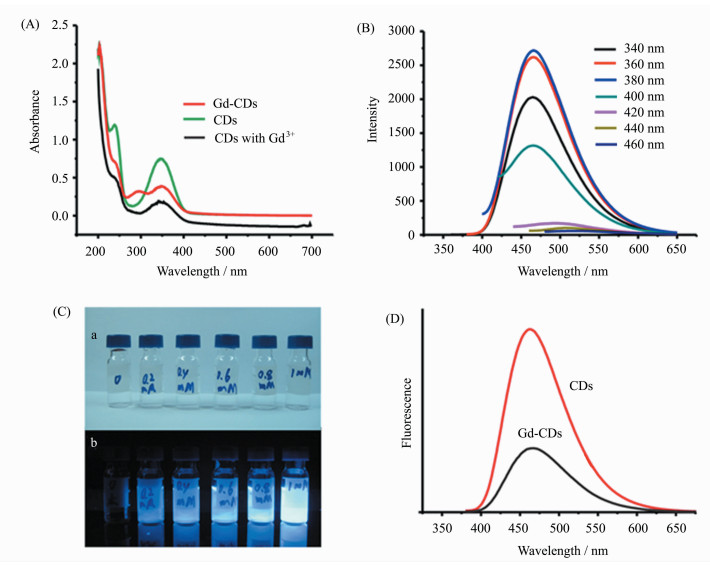
|
图 3 (A) Gd-CDs与CDs的紫外吸收光谱;(B) Gd-CDs在不同激发波长下的荧光光谱;(C)不同钆离子浓度的Gd-CDs的明亮荧光图像;(D)在360 nm激发波长下Gd-CDs与CDs的荧光光谱[18] |
Gd-CDs在紫外光的照射下可发出明亮的荧光且强度较高。同时,Gd-CDs在不同环境和条件下的荧光性能也较稳定。Yao等[14]合成的Gd-CDs水溶液在氙灯1 h的连续照射下,荧光强度几乎无变化。Chen等[16]制备的Gd-CDs在紫外光照射下持续24 h,荧光强度也不会发生变化。
2.2 磁学特性磁性CDs是指将带有顺磁性的离子与具有荧光性的CDs相结合,使反应得到的磁性CDs同时具有发射荧光的能力与核磁共振成像能力[19]。Gd-CDs具有较强的顺磁性,在核磁造影剂方面具有广阔的应用前景。
Gong等[15]通过微波法制得的Gd-CDs,随钆离子浓度增加,T1相的MRI信号逐渐增强,弛豫值高达11.365 M-1·s-1。张丽等[20]提出Gd-CDs与钆喷酸葡胺的T1加权图像信号随Gd浓度的增加而逐渐增强,增大的弛豫效率可能与Gd-CDs较大的流体动力学半径与表面积有关:Gd-CDs获得更大的水力半径及表面积,水分子就更易获得,所以缩短了纵向弛豫和增强弛豫效率。其制备的Gd-CDs弛豫效率为6 mM-1·s-1,高于在相同条件下的核磁造影剂钆喷酸葡胺的弛豫效率(4.05 M-1·s-1)。He等[21]得到的Gd-CDs弛豫率分别为57.63和11.40 mM-1·s-1,远远高于医用核磁造影剂钆喷酸葡胺的弛豫率(3.75 m M-1·s-1)。Yao等[14]证明Gd-CDs在T1和T2序列下的弛豫效率与其浓度呈明显的线性关系,r1和r2分别为11.429和15.328 mM-1·s-1,r2/r1的值达到了1.35,与医用核磁T1造影剂钆喷酸葡胺(r2/r1=1.1)相比具有更高的顺磁性,说明获得的Gd-CDs磁性超过常用的T1造影剂。
还有研究证实反应温度的改变会影响Gd-CDs的磁性大小。袁雪霞等[12]通过改变反应温度探究其对Gd-CDs磁性的影响,在220 ℃时得到的Gd-CDs弛豫时间最短为1187.9 ms,相应的弛豫率最大值为9.87 m M-1·s-1。Gd-CDs较大的比表面积可能是其弛豫性能优越的原因,这一特点使周围水质子与钆离子更易充分接触。
目前,Gd-CDs的磁学特性在动物试验中也得到了证实。Zheng等[22]用动物实验验证了Gd-CDs在核磁成像中的潜力,在不同时间点分别向小鼠体内注射钆喷酸葡胺及Gd-CDs并获得T1图像,结果显示:小鼠在注射钆喷酸葡胺30 min内的MR信号达到高峰,在2 h内为低信号,然而注射钆掺杂CDs的小鼠在12 h后仍然保持高信号,更重要的是在实验中实验组的MRI信号始终高于对照组(如图 4)。这些结果表明Gd-CDs可作为有效T1造影剂用于体内成像。
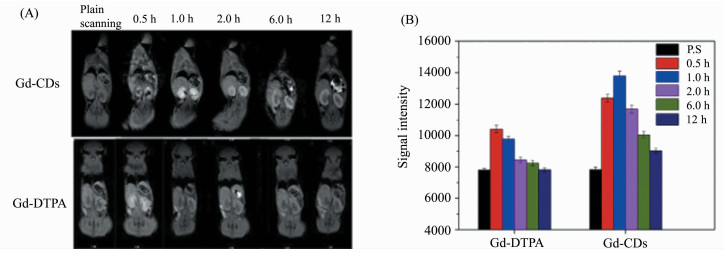
|
图 4 向小鼠体内注射Gd-CDs与钆喷酸葡胺前/后,在不同时间点(0.5 h、1 h、2 h、6 h、12 h)的(A) T1加权图像;(B)小鼠肾脏的信号强度[22] |
Gd-CDs在生物体内应用,不仅需要具备优异的荧光特性和磁性,还必须保证低毒性和生物相容性。在生物体内游离的钆离子若不能进行有效代谢,在体内积聚会引起生物通路毒性,最终导致肾功能不全[23]。而钆离子与CDs螯合后会大大降低其细胞毒性,Gd-CDs的生物相容性甚至优于其它核磁造影剂[24]。Yu等[13]以柠檬酸为碳源、氯化钆为钆源、乙烯三胺为表面修饰剂,用水热法制备了Gd-CDs,在生物相容性实验中,当Gd-CDs的浓度为1 mg·mL-1时,HeLa细胞的成活率可达90%以上;延长培养时间至48 h时,其细胞成活率与单纯在CDs溶液中培养的HeLa细胞成活率几乎一致,这证明钆离子和羧基的螯合阻止了钆离子的扩散,Gd-CDs中的钆离子不会对HeLa细胞产生明显的细胞毒性。袁雪霞等[12]证实Gd-CDs中的Gd3+是以螯合的方式掺杂于CDs中。用CCK-8法研究其对HeLa细胞的毒性,结果表明HeLa细胞在低浓度Gd-CDs的培养基溶液中的活度与空白对照组的活度相同,当Gd-CDs培养基溶液浓度达到2 mg·mL-1时,HeLa细胞的活度才降低至80%。
研究者也证实了与目前临床上常用的核磁造影剂相比,Gd-CDs的细胞毒性较低。Xu等[18]研究了Gd-CDs对HepG2细胞的细胞毒性,结果得到Gd-CDs培养基溶液中HepG2细胞活性为96%;同时在钆喷酸葡胺溶液中培养的HepG2细胞活性为90%,说明Gd-CDs具有细胞毒性低的特点;通过将Gd-CDs注入小鼠体内,观察小鼠各器官组织及体重变化来评价Gd-CDs在小鼠体内的长期毒性,结果显示实验组与对照组相比,小鼠体重和组织器官未见明显差异,此结果在生物体层面证实Gd-CDs具有良好的生物相容性。
3 Gd-CDs在双模态成像中的应用Gd-CDs独特的荧光特性和磁性,使其在各类细胞以及生物体内可作为双模态探针应用,在体内或体外成像领域都有着巨大发展前景。肿瘤在出现临床症状之前,在细胞、分子水平就已发生了结构和功能的变化,双模态成像是肿瘤早期诊断、监测及疗效评价的重要手段。Gong等[15]为验证Gd-CDs细胞成像的可能性,对注入Gd-CDs的大鼠神经胶质瘤细胞进行培养,对照组为未加入Gd-CDs的神经胶质瘤细胞。用共聚焦激光扫描显微镜观察,当激发波长为405 nm时,注入Gd-CDs的神经胶质瘤细胞发出明亮的绿光,而对照组未发出荧光,证明Gd-CDs可作为一种用于细胞成像的高效纳米探针。
在生物成像中,相比单一荧光,多种荧光可以为细胞成像提供更精确的信息。Zheng等[22]用786-O人肾癌细胞和HO-8910人卵巢细胞来验证Gd-CDs的细胞成像以及生物成像性能。研究发现,在不同激发波长下,注入Gd-CDs的两种癌细胞发出红色、绿色、蓝色三种荧光,在共聚焦激光扫描显微镜下证实了Gd-CDs通过内吞作用进入细胞质而不进入细胞核,在对细胞低伤害的前提下实现细胞成像,说明Gd-CDs具有良好的细胞成像和生物成像潜力。
Gd-CDs在生物体内存在某种器官及肿瘤靶向性,这点可以在生物成像中得到验证,此种特性使其在肿瘤靶向领域有很大的潜力。Xu等[18]以Gd-CDs为双模态分子探针,观察其在斑马鱼体内的磁性成像和荧光成像。因为斑马鱼的胚胎是透明的,能够观察到Gd-CDs在胚胎体内的运输过程;而且其发育时间短且易于控制,所以选择其作为生物模型[25, 26]。该Gd-CDs沉积在斑马鱼胚胎的绒毛膜上,与对照组相比较,当Gd-CDs浓度逐渐升高时,MRI的信号也逐渐增强(图 5)。在胚胎内的Gd-CDs的荧光及磁性不会发生改变,证实了Gd-CDs有作为双模态荧光探针的潜力。将Gd-CDs注射进大鼠体内,发现大鼠肝脏的MRI信号极大地增强,并且在肝脏切片上可获得绿色荧光,证明Gd-CDs在肝脏有大量聚集。
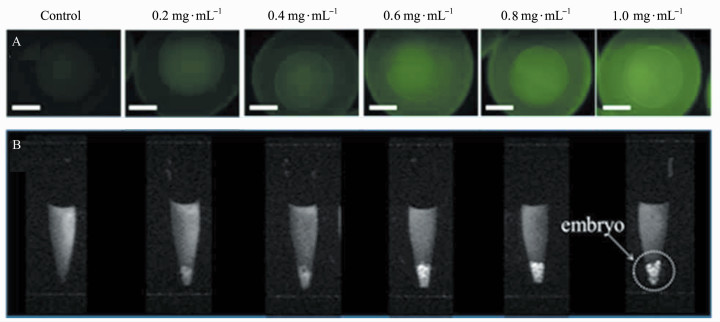
|
图 5 不同浓度Gd-CDs孵育的斑马鱼胚胎的荧光(A)和MRI(B)图像[18] |
除了在细胞及器官等肿瘤生物成像中得到验证,荧光-MRI双模态分子探针被证实可用于术前影像的准确监测及术中导航,对于手术是否成功有重要影响。Chen等[27]将获得的新型荧光-MRI双模态分子探针用于小鼠原位肝癌肿瘤和肝内转移肿瘤的术前诊断及术中实时指导根治性切除,在术中向小鼠模型注射探针,MRI及荧光图像均显示出清晰的肿瘤轮廓,包括微小的肿瘤病灶。
4 结论与展望综上所述,研究者在Gd-CDs的合成、光学特性、磁学特性、生物相容性及双模态成像中的作用等方面已获得了重要的研究成果。Gd-CDs利用其自身荧光特性标记肿瘤细胞,掺杂了钆离子使其具有核磁共振成像能力,并且具有良好的生物相容性,使其具有双模态分子探针的潜力,成为集肿瘤的监测和治疗为一体,具有控制释药、靶向药物转运、核磁成像能力的新型分子探针[24]。上述研究充分证实Gd-CDs作为一个新兴的碳纳米材料,已经在生物领域产生了一定影响。但是,若要应用于临床研究,依然面临很多挑战和问题。
(1) 优化Gd-CDs的合成和表征:目前,在Gd-CDs的制备中,碳源和钆源的选择与最终产物的结构和性质存在必然的关联,碳源的选择会影响产物的荧光量子产率,钆源选择对产物磁共振成像能力有影响。而且在Gd-CDs制备过程中,反应时间长短及反应温度高低也会影响钆离子在CDs中的掺杂程度。不同制备方式得到的产物粒径不同,粒径较小者更易进入细胞内并且具有较快的自旋速率,但其弛豫率可能会减小。今后的方向是通过不同的原料以及制备方式、反应条件的调控,研究其合成机理,探索出最优的水溶性、稳定性和弛豫率的双模态分子探针。此外,目前还缺少能准确又直观地表征Gd-CDs结构的方式。
(2) 探索肿瘤的特异性靶向治疗:在双模态分子探针表面修饰特异性靶向小分子如多肽、抗体等,将一种或多种肿瘤化疗药物负载在纳米颗粒上,结合成具有靶向性的药物制剂,可提高其对于肿瘤细胞的主动靶向性,为实现肿瘤的精准治疗提供可能,并突破目前癌症化疗效率低的瓶颈。同时可控制药物在人体内的释放速度,并在很长一段时间内维持血液内的药物浓度。目前,癌症治疗药物的主流研究方向是构建兼具主动及被动靶向的药物控释新系统,探索不同载药体系的药物释放速度、稳定性、精准度,以有效地降低抗肿瘤药物的毒副作用并达到治疗癌症的目的,双模态药物控释新系统有望成为一种治疗癌症的新型有效手段。
总之,Gd-CDs依然面对许多难题与挑战,为了解决上述问题还需纳米技术与医学相结合,拓宽Gd-CDs在双模态分子探针领域的应用,最终研发出新一代用于肿瘤诊疗的双模态分子影像探针。
| [1] |
Weissleder R, Mahmood U. Molecular imaging[J]. Radiology, 2001, 219(2): 316-333. DOI:10.1148/radiology.219.2.r01ma19316 |
| [2] |
杨卫, 张明如. 多模态分子探针的研究进展[J]. 功能与分子医学影像学(电子版), 2016, 5(2): 944-948. |
| [3] |
蒋伟, 房慧颖, 何晓静. 磁共振/光学双模态分子探针的研究现状与展望[J]. 影像科学与光化学, 2019, 37(2): 156-162. |
| [4] |
Li S, Wang F, He X W, et al. One-pot hydrothermal preparation of gadolinium-dope silicon nanoparticles as a dual-modal probe for multicolor fliorescence and magnetic resonance imaging[J]. Journal of Materials Chemistry B, 2018, 6: 3358-3365. DOI:10.1039/C8TB00415C |
| [5] |
Miao P, Han K, Tang Y, et al. Recent advances in carbon nanodots:synthesis, properties and biomedical applications[J]. Nanoscale, 2015, 7(5): 1586-1595. DOI:10.1039/C4NR05712K |
| [6] |
Ni K, Zhao Z, Zhang Z, et al. Geometrical confined ultrasmall gadolinium oxide nanoparticles boost the T1 contrast ability[J]. Nanoscale, 2016, 8(6): 3768-3774. DOI:10.1039/C5NR08402D |
| [7] |
Jain A, Koyani R, Muñoz C, et al. Magnetic-luminescent cerium-doped gadolinium aluminum garnet nanoparticles for simultaneous imaging and photodynamic therapy of cancer cells[J]. Journal of Colloid & Interface Science, 2018, 20: 1023-1028. |
| [8] |
Alzaki A, Joh D, Cheng Z, et al. Gold-loaded polymeric micelles for computed tomography-guided radiation therapy treatment and radiosensitization[J]. American Chemical Society Nanotechnology, 2014, 8(1): 104-112. |
| [9] |
Corines M J, Nougaret S, Weiser M R, et al. Gadolinium-based contrast agent during pelvic mri:contribution to patient management in rectal cancer[J]. Diseases of the Colon & Rectum, 2018, 61(2): 193-201. |
| [10] |
Zhou R H, Sun S K, Li C H. Enriching Mn-doped ZnSe quantum dots onto mesoporous silica nanoparticles for enhanced fluorescence/magnetic resonance imaging dual-modal bio-imaging[J]. American Chemical Society Applied Materials & Interfaces, 2018, 10(40): 34060-34067. |
| [11] |
车望远, 刘长军, 杨焜, 等. 荧光碳点的制备和性质及其应用研究进展[J]. 复合材料学报, 2016, 33(3): 7-26. |
| [12] |
袁雪霞.钆离子掺杂的碳量子点的制备和作磁共振-荧光双模态造影剂的性能研究[D].绵阳: 西南科技大学, 2013.
|
| [13] |
Yu C, Xuan T, Chen Y, et al. Gadolinium-doped carbon dots with high quantum yield as an effective fluorescence and magnetic resonance bimodal imaging probe[J]. Journal of Alloys and Compounds, 2016, 688: 611-619. DOI:10.1016/j.jallcom.2016.07.226 |
| [14] |
Yao H C, Su L, Zeng M, et al. Construction of magnetic-carbon-quantum-dots-probe-labeled apoferritin nanocages for bioimaging and targeted therapy[J]. International Journal of Nanomedicine, 2016, 11: 4423-4438. DOI:10.2147/IJN.S108039 |
| [15] |
Gong N Q, Wang H, Li S, et al. Microwave-assisted polyol synthesis of gadolinium-doped green luminescent carbon dots as a bimodal nanoprobe[J]. Langmuir, 2014, 30(36): 10933-10939. DOI:10.1021/la502705g |
| [16] |
Chen H, Wang G D, Tang W, et al. Gd-encapsulated carbonaceous dots with efficient renal clearance for magnetic resonance imaging[J]. Advanced Materials, 2014, 26(39): 6761-6766. DOI:10.1002/adma.201402964 |
| [17] |
Liu H P, Ye T, Mao C D. Fluorescent carbon nanoparticles derived from candle soot[J]. Angewandte Chemie International Edition, 2007, 46(34): 6473-6475. DOI:10.1002/anie.200701271 |
| [18] |
Xu Y, Jia X H, Yin X B, et al. Carbon quantum dot stabilized gadolinium nanoprobe prepared via a one-pot hydrothermal approach for magnetic resonance and fluorescence dual-modality bioimaging[J]. Analytical Chemistry, 2014, 86(24): 12122-12129. DOI:10.1021/ac503002c |
| [19] |
Zhang H, Wang T, Zheng Y, et al. Comparative toxicity and contrast enhancing assessments of Gd2O3@BSA and MnO2@BSA nanoparticles for MR imaging of brain glioma[J]. Biochemical & Biophysical Research Communications, 2018, 449(3): 488-492. |
| [20] |
张丽.新型钆掺杂碳量子点用于肿瘤靶向性成像及其放疗增敏研究[D].镇江: 江苏大学, 2016.
|
| [21] |
He X, Luo Q, Zhang J, et al. Gadolinium-doped carbon dots as nano-theranostic agents for MR/FL diagnosis and gene delivery[J]. Nanoscale, 2019, 11(27): 12973-12982. DOI:10.1039/C9NR03988K |
| [22] |
Zheng S, Yu N, Han C, et al. Preparation of gadolinium doped carbon dots for enhanced MR imaging and cell fluorescence labeling[J]. Biochemical and Biophysical Research Communications, 2019, 511(2): 207-213. DOI:10.1016/j.bbrc.2019.01.098 |
| [23] |
Weng Q, Hu X, Zheng J, et al. Toxicological risk assessments of iron oxide nanocluster- and gadolinium-based T1 MRI contrast agents in renal failure rats[J]. American Chemical Society Nanotechnology, 2019, 13(6): 9025-9033. |
| [24] |
Chen H, Wang G D, Tang W, et al. Gd-encapsulated carbonaceous dots with efficient renal clearance for magnetic resonance imaging[J]. Advanced Materials, 2014, 26(39): 6761-6766. DOI:10.1002/adma.201402964 |
| [25] |
闫鹏, 艾凡荣, 严喜鸾, 等. 碳量子点的生物应用:成像、载药与毒性[J]. 材料导报, 2017, 31(10): 38-45. |
| [26] |
Kang Y F, Li Y H, Fang Y W, et al. Carbon quantum dots for zebrafish fluorescence imaging[J]. Scientific Reports, 2015, 5: 11835. DOI:10.1038/srep11835 |
| [27] |
Chen Q S, Shang W T, Zeng C T, et al. Theranostic imaging of liver cancer using targeted optical/MRI dual-modal probes[J]. Oncotarget, 2017, 8(20): 32741-32751. DOI:10.18632/oncotarget.15642 |



