未经切除的原发性和继发性肝癌病人5年生存率约为3%。切缘阴性的手术切除可将5年生存率从20%增加到30%[1]。手术的关键在于能否去除足够的组织以达到切缘阴性,同时保留足够多的健康肝组织以减少切除后肝衰竭的风险。手术的基本点是找出与肿瘤和正常肝组织关系密切的血管支流[2, 3]。当前的手术计划主要依赖于外科医生对2D计算机断层扫描成像(CT/MR)的理解和思维空间重建能力,这增加了认知负荷,因为它依赖于CT/MR解释、解剖学和外科知识以及医生的经验和空间感[4, 5],会影响术前评估的准确性,增加术中风险。而肝切除术最大的风险是术中大量出血,这与严重的术后并发症发生率和较差的总生存率相关[6]。因此一些新技术应运而生,其中基于Amira软件的三维立体重建技术可以模拟出人体内部各个器官的三维结构,立体显示肝脏及其周围毗邻器官,显示病灶与其周围组织,协助医生分析病灶可切除性,拟定最佳手术入路及手术切除范围,大大减少手术区域损伤,减少毗邻器官的意外误伤,提高了手术的精准性和安全性。此外,Amira是一款功能强大的软件,可以直接导入标准的DICOM医学图像,并且可以全自动进行各种平面图像处理、数据测算和三维模型设计。本实验结合肝脏解剖、肝脏动脉期和延迟期CT呈像,进行反复对比,并采取图像人工分离及软件自动调整、修饰等方法,构建出系统完整、个体匹配度极高的三维模型,其目的是确定术前肝脏及其周围重要脏器和血管的3D重建能否协助术者选择合适的肝切除方案并有效规避术中及术后并发症。
1 材料与方法 1.1 一般资料本项回顾性研究纳入连续111例于2014年1月~2018年12月之间入院确诊肝癌并进行肝切除术的患者,纳入标准:(1)原发性肝癌患者;(2)行开腹切除手术;(3)术前行上腹部平扫+多期增强CT。排除标准:(1)术前行新辅助治疗患者;(2)多发性肝癌患者;(3)未在我院行术前CT患者;(4)肝脏楔形切除患者;(5)有其他肝脏疾病或肿瘤病史患者;(6)因体质、营养状态、肿瘤分期等原因无法行手术治疗患者;(7)腔镜手术患者。其中2015年8月前的59例患者仅行术前CT(对照组),我院引入3D重建技术后的52例行同期肝脏及周围血管三维重建(观察组)。两组患者一般临床资料包括性别、年龄、Child-Pugh评分、吲哚氰绿15 min滞留率、AFP、肿瘤体积等一般病理资料如表 1所示。
| 表 1 两组间临床资料对比 |
将患者术前上腹部平扫+多期增强CT图像(层厚不超过1.50 mm)导入Amira软件,检查图像顺序,设置合适的窗宽、窗位。
1.2.2 图像剪切为更好地凸显观察区,去除无用信息,精简重建数据量,将原始图片剪切为每张966×620像素。
1.2.3 图像分割本研究采用的图像分割方法为计算机自动阈值分割加人工手动图像分割,先通过阈值分割法对靶器官进行初步分割,当自动识别不足或过多时需要手动进行适当的分割。图像分割具体包括肝脏、肝脏脉管系统、肝脏胆道系统及胆囊的图像分割。
1.2.4 肝脏表面重建经过人工修饰及计算机处理后便可获得由立体体素显示的三维模型。其中包括识别并提取出的肝实质、肿瘤、肝动脉、门静脉和肝静脉的图像信息,可以从各个方向清楚地观察到肿瘤的位置和大小以及邻近的脉管系统。根据三维重建图像,设计手术切除目标区域(至少5 mm的无肿瘤边缘)。但在某些情况下,由于邻近的脉管系统、肠或胆囊,不可能达到这样的安全范围。
1.3 肝切除术入组病人均根据原发性肝癌诊疗规范(2011版)制定手术方式,采用开腹式手术,术式分为:半肝切除、肝叶切除、肝段切除。手术采用左侧腹部反“L”形切口入路,探查腹腔后,由前方入路,解剖游离肝门下方GLISSON韧带,实施GLISSON蒂横断术。当肿瘤位于Ⅳ段时,术中需行超声检查,以确认肿瘤确切位置及其与大血管关系,并使用肝门板鞘外法放置选择性半肝入肝血流阻断带;当肿瘤位于其他肝段时,根据术中需要,选择性行超声检查以确定手术切缘,并保证残肝血供及静脉回流。最后放置术区腹腔引流管。
1.4 观察内容观察组分别通过术前三维重建及传统二维影像学检查两种方法评估计算术中预计肝切除体积,对比两种测量方法与实际肝切除体积间的差异;比较观察组与对照组间术前一般资料、手术时间、肝门阻断时间、实际肝切除体积(术后排水法测量)、术中出血量及术后并发症发生率间是否存在差异,并根据Child-pugh评分系统、血清丙氨酸氨基转移酶(ALT)、天冬氨酸转氨酶(AST)、总胆红素(TBIL)、白蛋白(ALB)和凝血酶原时间(PT)水平对术前术后肝功能进行评估;根据吲哚氰绿15 min时的滞留率(ICG15)评估术前存留的肝功能;参考术后病理结果分别计算观察组、对照组的R0切除率(R0切除为镜下病理无残留;R1切除为肉眼下无肿瘤残留,但镜下存在残留;R2是肉眼和镜下均有残留)。
术后主要并发症的定义如下:(1)肝切除术后腹腔出血:术后血红蛋白水平降低> 3 g/dL;需要进行介入止血(例如栓塞术)和/或手术止血;通过腹腔引流管或影像学检查证实腹腔内进行性出血;(2)胆漏:是指在术后3天由于胆源性腹膜炎而进行二次手术患者,或引流液胆红素与血清胆红素之比> 3;(3)肝切除术后肝衰竭:为手术第5天之后国际标准化比率(INR)和血胆红素持续升高;(4)脓毒血症的临床诊断定义为有明确感染的全身炎症反应综合征,需满足以下4个变量中的2个或2个以上阳性指标:①体温过高(> 38.3 ℃)或体温过低(< 36 ℃);②心动过速(> 90次/min);③呼吸急促(速率≥20次/ min)或缺氧[指脉氧饱和度 < 90%或需要吸入氧气分数(FiO2)≥0.4的氧气以保持足够的氧饱和度];④白细胞增多症[白细胞(WBC)计数> 12.0×109细胞/ L],白细胞减少症:白细胞计数 < 4×109细胞/ L,或未成熟白细胞> 10%。术后如上述全身感染阳性指标少于2个,辅助检查或查体发现局部感染证据,可分为:切口感染、肺部感染、腹腔感染[7, 8]。
1.5 统计学方法连续变量采用均数±标准差(x±s)或中位数与四分位间距表示,t检验和秩和检验用于检测两连续变量间均值和中位数的差异;基于三维重建与二维方法预估肝脏切除体积间的差异,采用配对t检验;使用卡方检验或Fisher精确检验验证观察组与对照组并发症发生率是否有差异。统计检验均为双侧,概率(P)值< 0.05被认为具有统计学意义。所有分析均使用SPSS软件21.0进行。
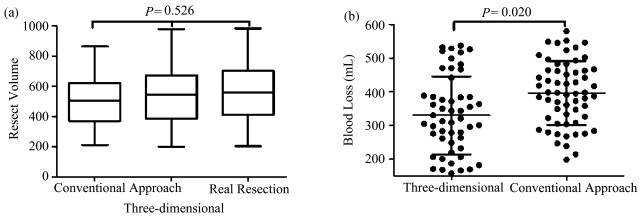
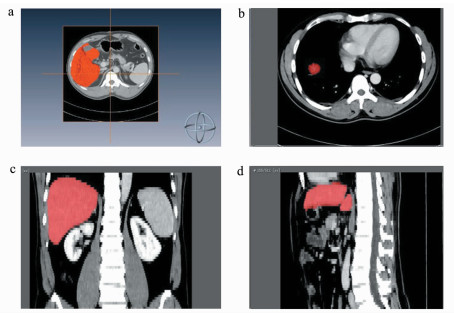
2 结果 2.1 Amira三维重建技术用于肝切除体积的估算观察组通过三维重建评估的肝切除体积相较于传统影像学方法,更接近于术中实际肝切除体积:2D预计切除体积为(514.73±173.60)cm3;3D预计切除体积为(537.96±183.23)cm3;术中实际切除体积为(556.31±183.16)cm3。但通过方差分析证实三者之间的差异无统计学意义(F=0.645,P=0.526),如图 1a所示,因此三维重建对于肝切除范围的评估并不逊色于传统方法。用Amira三维立体重建技术对肝脏体积进行测算的图像见图 2。
|
图 1 (a) 3D重建和2D技术制定的手术切除体积与实际切除体积大小差异不大(ANVOA test);(b)两种不同术前评估方案,术中出血量存在统计学差异(Student’s t test) |
|
图 2 基于Amira软件的三维立体重建技术进行肝脏测算 a.横断面肝脏下界;b.横断面肝脏上界;c. Amira软件自动测量冠状面肝脏大小;d. Amira软件于矢状面对肝脏进行测量 |
在性别、年龄、Child-Pugh评分、肿瘤大小、ICG R15等指标无明显差异的两组样本中(表 1),虽然通过三维重建得出的肝脏预切除体积与传统方式差异不大(图 1),但该技术却显著提高了手术患者的R0切除率(88.46% vs 71.19%, P=0.025,见表 2),这与更加完善的术前评估相关,提高了非R0切除患者的术前检出率。
| 表 2 精准肝切除术中参数的对比 |
经过统计,观察组手术平均时间稍短于对照组,但该差异无统计学意义(P=0.330)。而肝门阻断时间和术中出血量在观察组中得到了有效控制,如表 2和图 1b。
2.4 两组患者术后并发症的发生率使用三维重建技术明显减少了术后并发症的发生率(P=0.042),如表 3所示,该技术可以发现术前解剖变异,提醒术者规避风险,也更加完善术前评估,准确评估手术难度,甚至可以发现传统方法不能发现的相对手术禁忌症。
| 表 3 术后并发症发病率及住院时间对比 |
人体最大的实体器官——肝脏,其解剖结构复杂,拥有肝动脉及门静脉两套独立供血系统,因此,仅有的一套静脉回流系统显得尤为重要,进行肝脏手术时保护肝静脉的重要性不言而喻。而尾状叶又有单独的一套血流系统,这又增加了肝脏解剖的复杂性及肝脏外科手术难度。Couinaud[9]根据肝动脉和门静脉的血液供应将肝脏分为8个功能部分,即8个分段,由于肝癌手术要在切缘阴性的前提下保留最大的肝体积,以防止术后肝衰竭,所以术者了解肝脏的复杂解剖结构,对于制定手术切除范围至关重要。尤其对于那些新辅助化疗后或潜在肝损伤的病人,术前掌握肝中静脉解剖,对于术中避免损伤静脉主干、移植手术中选取供肝标准、确保残肝静脉回流通畅、是否需静脉重建等问题具有重要意义。但肝脏静脉解剖变异率较高,术前并不能预知手术难度及准确的肝脏血管走行,这便对现行的手术理念提出了挑战,精准肝切除术也就应运而生。
随着现代肝胆外科与影像技术及计算机科技的不断交叉融合,外科医师的诊疗手段也有翻天覆地的变化,三维重建技术便是临床应用较为广泛的新型科技之一。以往手术前如果仅通过传统2D方法主观判断图像中的肝血管分支和肝实质,医生必须通过空间思维重建3D结构并制定手术计划,以整合多重信息来源,这种高频率的思维交互必定会产生大量认知负担,导致注意力分散[10-12]。认知负荷量是一个人同一时间内能处理的最大信息量[13],因此减少信息量可以减轻医师的认知压力,更有效率地处理手术信息。Amira就是这样一款功能强大、使用便捷、重建模型匹配度高的医学影像处理软件,其重建的图像清晰逼真,可以随意旋转、调换角度、层次虚化以观察肝脏内部各层次结构。然而靠近肝门的肝左叶位置与胃壁、第三肝门、大网膜等组织相邻,不可过分依赖程序所分离出的图像,需要再次手工修饰,以保证重建后模型的匹配率。
本研究结果提示, 术前三位重建有助于提高R0切除率,这不仅说明肝脏的精准切除术确有成效,更说明了完善的术前评估能提高非R0切除患者的术前检出率。与本研究相似,有报道称3D重建提高了医师制定手术切除计划的准确性,提高了他们的手术能力和信心,并且高年资医生也无法通过2D图像始终如一地制定正确的手术切除计划[14],因此3D重建技术不限于肝脏的精准治疗,对于所有外科治疗品质的提升均具有帮助。文献指出三维重建技术能让肝胆外科医师更精确地了解肝脏血液灌注情况,改善传统2D平面术前评估策略,优化手术方案[15]。本研究也证实了这一点,通过3D重建的观察组术中出血量明显减少,这与更精确的术前规划密不可分,术中不仅规避了解剖变异的血管和血流丰富的血窦,也可以完整地、符合切缘要求地切除瘤体,从而减少了术中误伤主要血管、胆管的风险,降低了术中、术后并发症的发生率。
综上所述,基于Amira软件的三维立体重建技术有助于提高肝癌患者的R0切除率,术前明确患者肝脏解剖变异,优化手术方案,指导个体化治疗,实现精准治疗。本研究为单中心、回顾性研究,入组病例较少,得出结论可能存在偏倚,且没有长期随访数据,无法评估观察组与对照组手术治疗效果是否存在差异,期待更大样本量的多中心前瞻性随机对照实验的验证及补充。
4 结论三维重建技术用于肝脏的术前评估能减小术者的认知负担,提高医师制定切除方案的合理性,提高R0切除率,降低术后并发症的发生率,是一种安全、有效的临床辅助检查手段。
| [1] |
Siegel R L, Miller K D, Jemal A. Cancer statistics, 2017[J]. CA:A Cancer Journal for Clinician, 2017, 67(1): 7-30. |
| [2] |
Vauthey J N, Chaoui A, Do K A, et al. Standardized mea-surement of the future liver remnant prior to extended liver resection:methodology and clinical associations[J]. Surgery, 2000, 127(5): 512-519. DOI:10.1067/msy.2000.105294 |
| [3] |
Lang H, Radtke A, Hindennach M, et al. Impact of virtual tumor resection and computer-assisted risk analysis on operation planning and intraoperative strategy in major hepatic resection[J]. Archives of Surgery (Chicago, Ill.: 1960), 2005, 140(7): 629-638; discussion 638.
|
| [4] |
Pratte M S, Tong F. Spatial specificity of working memory representations in the early visual cortex[J]. Journal of Vision, 2014, 14(3): 22. |
| [5] |
Manson A, Poyade M, Rea P. A recommended workflow methodology in the creation of an educational and training application incorporating a digital reconstruction of the cerebral ventricular system and cerebrospinal fluid circulation to aid anatomical understanding[J]. BMC Medical Imaging, 2015, 15: 44. DOI:10.1186/s12880-015-0088-6 |
| [6] |
Clipet F, Rebibo L, Dembinski J, et al. Portal vein variants associated with right hepatectomy:An analysis of abdominal CT angiography with 3D reconstruction[J]. Clinical Anatomy, 2019, 32(3): 328-336. DOI:10.1002/ca.23315 |
| [7] |
Mai R Y, Wang Y Y, Bai T, et al. Combination of ALBI and APRI to predict post-hepatectomy liver failure after liver resection for HBV-related HCC patients[J]. Cancer Management and Research, 2019, 11: 8799-8806. DOI:10.2147/CMAR.S213432 |
| [8] |
Okabe H, Hayashi H, Higashi T, et al. Frailty predicts severe postoperative complication after elective hepatic resection[J]. Gastrointest Tumors, 2019, 6(1-2): 28-35. DOI:10.1159/000500086 |
| [9] |
Couinaud C. Liver anatomy:portal (and suprahepatic) or biliary segmentation[J]. Digestive Surgery, 1999, 16(6): 459-467. DOI:10.1159/000018770 |
| [10] |
Grunwald T, Corsbie-Massay C. Guidelines for cognitively efficient multimedia learning tools:educational strategies, cognitive load, and interface design[J]. Academic Medicine:Journal of the Association of American Medical Colleges, 2006, 81(3): 213-223. DOI:10.1097/00001888-200603000-00003 |
| [11] |
Woodward A L, Sommerville J A, Gerson S, et al. The emergence of intention attribution in infancy[J]. The Psychology of Learning and Motivation, 2009, 51: 187-222. DOI:10.1016/S0079-7421(09)51006-7 |
| [12] |
van Merriënboer J J, Sweller J. Cognitive load theory in health professional education:design principles and strategies[J]. Medical Education, 2010, 44(1): 85-93. DOI:10.1111/j.1365-2923.2009.03498.x |
| [13] |
Knoop-van Campen C A N, Segers E, Verhoeven L. The modality and redundancy effects in multimedia learning in children with dyslexia[J]. Dyslexia, 2018, 24(2): 140-155. DOI:10.1002/dys.1585 |
| [14] |
Yeo C T, MacDonald A, Ungi T, et al. Utility of 3D reconstruction of 2D liver computed tomography/magnetic resonance images as a surgical planning tool for residents in liver resection surgery[J]. Journal of Surgical Education, 2018, 75(3): 792-797. DOI:10.1016/j.jsurg.2017.07.031 |
| [15] |
Radtke A, Sotiropoulos G C, Molmenti E P, et al. Compu-ter-assisted surgery planning for complex liver resections:when is it helpful? A single-center experience over an 8-year period[J]. Annals of Surgery, 2010, 252(5): 876-883. DOI:10.1097/SLA.0b013e3181fdd012 |


