乳腺癌是女性常见的恶性肿瘤, 近年来,乳腺癌的发病率及死亡率均呈明显上升趋势[1],严重威胁着女性健康。根据2013年美国放射学会(American College of Radiology,ACR)建立并推荐的乳腺影像报告和数据系统(Breast Imaging Reporting and Date System,BI-RADS)的标准[2], BI-RADS 4类病变可以细分为4A、4B、4C,恶性程度分别为3%~30%、31%~60%、61%~94%[3, 4],这些病灶较小或为多灶性病变,常规乳腺X线摄影和超声不易显示,需进行活检等进一步检查以获得定性诊断[5]。对比增强乳腺X线摄影(contrast enhanced specral mammography, CESM)是乳腺X线成像技术的一项新进展,该技术利用碘的K缘效应[6](33.2 keV),注射碘对比剂后,对同一体位进行高能(45~49 kVp)和低能(26~31 kVp)图像采集,通过融合和减影获得低能图像和减影图像,减影图剔除了乳腺正常软组织且额外提供了病灶的血供信息,可以显著减少假阳性和假阴性的结果,提高特异性和灵敏度,评价病变的准确性更高[7, 8]。本文旨在通过对CESM减影图像中病灶的强化程度和强化类型进行分析,以研究其对BI-RADS 4类病变的鉴别效果。
1 材料与方法 1.1 研究对象连续收集2017年1月~2018年7月在我院乳腺外科就诊的患者,纳入标准: (1)所有患者均行双侧乳腺CESM检查;(2)乳腺病灶诊断报告评为BI-RADS 4类;(3)经手术或穿刺活检证实,有明确的病理诊断结果。排除标准: (1)既往有乳腺手术史或接受过乳腺治疗;(2)备孕、妊娠和哺乳期女性;(3)对碘对比剂过敏的患者;(4)肾脏功能不全的患者。检查前将对比剂使用的适应症、禁忌症、可能发生的不良反应和注意事项充分告知患者或其监护人,并签署“碘对比剂使用患者知情同意书”。本研究共收集60例女性患者,年龄为28~75岁,平均(48.42±2.12)岁,共60个乳腺病灶。
1.2 仪器与方法所有患者均采用GE Senographe Essential CESM钼靶机进行乳腺X线摄影,通过高压注射器经前臂静脉注射对比剂碘海醇(300 mg/mL),剂量为1.5 mL/kg,速率为2.0~3.0 mL/s。从注射对比剂开始计时,2 min后开始摄影,7 min内完成双乳头尾位(craniocaudal, CC)和内外斜位(mediolateral obliqde,MLO)屏气摄影。拍摄顺序:患侧CC位→非患侧CC位→非患侧MLO位→患侧MLO位,一次压迫完成低、高能两次曝光,可获得一张低能图像和一张经过特定算法处理的碘特异性减影图像。
1.3 图像分析两位从事乳腺诊断工作10年以上的放射医生在GE后处理工作站上采用双盲法分别测量CESM减影图的CC位和MLO位兴趣区(region of interest, ROI)的信号强度,ROI位于病灶强化最显著部分,面积0.3 cm2,计算:①增强后病灶与背景的差异百分比(RS%):RS%=(病灶信号强度-背景信号强度)/背景信号强度×100%;②对比噪声比(contrast noise ratio,CNR):CNR=(病灶信号强度-背景信号强度)/背景信号强度标准差。并对比病灶在CC位和MLO位强化程度的差值,将病灶的强化类型分为:流入型(Ⅰ型,CC位强化程度低于MLO位)、平台型(Ⅱ型,CC位强化程度和MLO位一致)、流出型(Ⅲ型,CC位强化程度高于MLO位)。以病理结果为金标准, 分析良恶性组之间病灶的RS%、CNR以及病灶强化类型之间的差异有无统计学意义。
1.4 统计学方法采用统计软件SPSS 20.0进行统计学处理, Kolmogorov-Smirnov检验数据是否符合正态分布, 正态分布计量资料以x±s表示,偏态分布以中位数(四分位数间距)[M(Q1,Q3)]表示。采用Mann-Whitney U检验分析良恶性组间病灶强化程度的差异,P < 0.05时认为差异有统计学意义;采用χ2检验分析良恶性组间强化类型的差异, P < 0.01时认为差异有统计学意义。
2 结果 2.1 病理结果60例患者总计有60个病灶,均经病理结果证实(表 1),其中21例经乳腺病灶核心穿刺病理证实,13例为手术切除术后病理证实,26例为乳腺病灶核心穿刺+手术切除术后病理证实。
| 表 1 乳腺病灶组织病理检查结果 |
良恶性病灶组之间CC位和MLO位RS%和CNR的差异见表 2, 两组之间差异无统计学意义(P>0.05)。
| 表 2 良恶性组间CC位和MLO位RS%和CNR的差异 |
良恶性病灶两组之间的强化类型见表 3, 两组之间差异有统计学意义(χ2=13.042,P < 0.01)。
| 表 3 良恶性组病灶强化类型分析 |
Ⅰ型病灶中87%为良性,13%为恶性;Ⅱ型病灶中55.6%为良性,44.4%为恶性;Ⅲ型病灶中15.8%为良性,84.2%为恶性。说明恶性病灶常表现为Ⅱ型、Ⅲ型,良性病灶常表现为Ⅰ型、Ⅱ型,差异有统计学意义。典型病例的对比增强能谱乳腺X线摄影减影图见图 1。
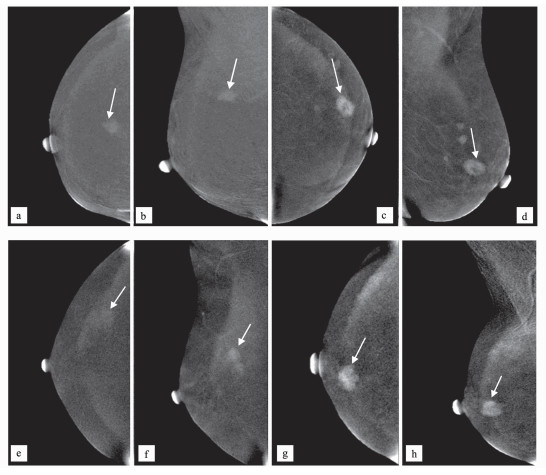
|
图 1 典型病例的对比增强能谱乳腺X线摄影减影图
a-b,47岁女性,CC位(a)和MLO位(b)在右乳中央区偏上份均可见一强化肿块影,诊断为4C类,强化类型表现为Ⅱ型,病理证实为浸润性导管癌; c-d,53岁女性,左乳外上象限可见多发肿块伴强化,CC位病灶(c)强化程度大于MLO位(d),诊断为4C类,强化类型表现为Ⅲ型,病理证实为浸润性癌; e-f,44岁女性,CC位病灶(e)强化程度小于MLO位(f),强化类型表现为Ⅰ型,右乳外象限明显强化, 诊断为4C类, 病理证实为腺病伴纤维腺瘤; g-h,28岁女性,右乳中央区强化肿块影,诊断为4B类,CC位病灶(g)的强化程度和MLO位相当(h),强化类型表现为Ⅱ型,病理证实为纤维腺瘤 |
CESM是在传统乳腺X线摄影基础上,通过使用碘对比剂突出血流量增强的区域以实现乳腺疾病检出目的的新技术[8]。由于恶性乳腺肿瘤的生长需要大量营养,会形成新的小血管,这些微小血管易“渗漏”,即对比剂通过体循环进入肿瘤使病灶强化,因此,CESM相较于传统乳腺X线摄影,对乳腺癌检出的敏感度和特异度更高[9, 10]。Łuczyńska等[11]研究结果显示,相较于传统乳腺X线成像和超声检查,CESM检查技术对BI-RADS评分的准确性最高(100%),其次为乳腺超声(92%)和传统乳腺X线成像(90%),所以CESM是一种非常有价值的诊断方法,可以为恶性乳腺病变提供最准确的BI-RADS分级。由于目前尚无CESM的判读标准,且BI-RADS 4类病灶的恶性程度跨度较大,因此如何通过CESM减影图上病灶的强化程度和强化类型来辨别乳腺病变的良恶性尤为重要。
Rudnicki等[12]对167个乳腺病灶的强化程度与病理结果进行分类比较,发现浸润性癌与原位癌在强化程度上存在显著差异,原位癌与良性病灶在强化程度上无显著差异。Badr等[13]报道乳腺恶性肿瘤新生血管较多,在减影图上表现为重度或中度肿块样强化,而良性病灶往往显示为无强化。但Patel等[14]研究显示某些乳腺良性病变的新生血管血供也比较丰富,在减影图上表现为肿块样强化。由此可见既往研究对于良性乳腺病灶是否显著强化的结论并不一致。本研究选取的60个病灶中有27个恶性病灶、33个良性病灶,良性病灶中包含纤维腺瘤、腺病和乳头状瘤等,均显示异常强化,这些减影图上显示为肿块样强化的良性病灶易被误判成恶性病灶,进而影响诊断和治疗。本研究对减影图像中病灶强化最显著的部分进行了信号强度测量,并对病灶增强值进行了计算和分析,结果显示恶性病灶与良性病灶在CC位和MLO位的RS%和CNR值差异均无统计学意义(P>0.05),说明乳腺良恶性病灶之间强化程度的差异并无显著性。因此,在判读BI-RADS 4类病灶时不能仅凭病灶有无强化或强化程度高低来鉴别良恶性,而需要结合低能图和病灶大小等性质进行综合分析[15]。
本研究拍摄顺序是将可疑病灶侧乳腺CC位安排在开始拍摄,并将其MLO位拍摄安排在对侧乳腺CC位和MLO位之后,这是因为Bhimani等[16]研究指出这种拍摄顺序是为了争取抓取病灶动脉早期以及延迟期摄取对比剂的情况,尽可能减少对比剂过早流出或过晚开始强化导致的假阴性。Vera等[17]研究表明CESM提供的乳腺恶性肿瘤信息与MRI相似,而MRI时间-信号强化曲线(dynamic contrast enchancement-time intensity curve,DCE-TIC)对乳腺疾病的良恶性鉴别具有重要意义。本文中CESM增强扫描的时间也是在患者对比剂注入2 min后,根据两个体位病灶强化程度的差值来评估病灶强化方式,分为Ⅰ型、Ⅱ型、Ⅲ型。结果显示27个恶性病灶多表现为Ⅱ型、Ⅲ型(88.9%),33个良性病灶多表现为Ⅰ型、Ⅱ型(90.9%)。而9.1%的良性病灶表现为Ⅲ型强化,可能与病灶细胞成分较多有关,如非硬化性导管乳头状瘤;11.1%的恶性病灶呈Ⅰ型强化,可能与肿瘤的成分致密,对比剂进入肿瘤周围间质较缓慢有关。Ⅰ型和Ⅲ型能较好地提示病灶的性质,但Ⅱ型中良恶性交叉较多,所以还需要结合临床进行更深入的研究。
本研究也存在一些不足之处: 1. CESM应用于临床的时间较短,积累的经验不够丰富,在判断病灶强化的标准上仍有差异;2.由于病灶大小存在差异,ROI的大小也存在一些偏差;3.本研究样本量较小,在后续研究中将进一步扩大样本量。综上所述,不能仅凭对比增强能谱乳腺X线摄影中病灶的强化程度来鉴别病灶的良恶性,而病灶强化类型分析可以对诊断乳腺影像报告和数据系统分类为4类的病灶良恶性鉴别提供一定依据。
| [1] |
陈万青, 郑荣寿. 中国女性乳腺癌发病死亡和生存状况[J]. 中国肿瘤临床, 2015, 42(13): 668-674. DOI:10.3969/j.issn. 1000- 8179.20150571 |
| [2] |
Mori M, Akashi-Tanaka S, Suzuki S, et al. Diagnostic accuracy of contrast-enhanced spectral mammography in comparison to conventional full-field digital mammography in a population of women with dense breasts[J]. Breast Cancer, 2017, 24(1): 104-110. DOI:10.1007/s12282-016-0681-8 |
| [3] |
Chaiwerawattana A, Thanasitthichai S, Boonlikit S, et al. Clinical outcome of breast cancer BI-RADS 4 lesions during 2003-2008 in the National Cancer Institute Thailand[J]. Asian Pacific Journal of Cancer Prevention, 2012, 13(8): 4063. DOI:10.7314/APJCP.2012.13.8.4063 |
| [4] |
Yoon J H, Kim M J, Moon H J, et al. Subcategorization of ultrasonographic BI-RADS category 4:positive predictive value and clinical factors affecting it[J]. Ultrasound in Medicine & Biology, 2011, 37(5): 693-699. |
| [5] |
Chen W, Zheng R, Zhang S, et al. Cancer incidence and mortality in China, 2013[J]. Cancer Letter, 2017, 401: 63-71. DOI:10.1016/j.canlet.2017.04.024 |
| [6] |
Seibert J A. The Essential Physics of Medical Imaging[M]. Philadelphia: Lippincott Williams & Wilkins, 2013.
|
| [7] |
Bhimani C, Li L, Liao L, et al. Contrast-enhanced spectral mammography:modality-specific artifacts and other factors which may interfere with image quality[J]. Academic Radio-logy, 2017, 24(1): 89-94. DOI:10.1016/j.acra.2016.08.024 |
| [8] |
Patel B K, Lobbes M B I, Lewin J, et al. Contrast enhanced spectral mammography:a review[J]. Seminars in Ultrasound CT and MRI, 2018, 39(1): 70-79. DOI:10.1053/j.sult.2017.08.005 |
| [9] |
Cheung Y C, Juan Y H, Lin Y C, et al. Dual-energy contrast-enhanced spectral mammography:enhancement analysis on BI-RADS 4 non-mass microcalcifications in screened women[J]. Plos One, 2016, 11(9): e0162740. DOI:10.1371/journal.pone.0162740 |
| [10] |
Cheung Y C, Lin Y C, Wan Y L, et al. Diagnostic performance of dual-energy contrast-enhanced subtracted mammography in dense breasts compared to mammography alone:interobserver blind-reading analysis[J]. Europe Radiology, 2014, 24(10): 2394-2403. DOI:10.1007/s00330-014-3271-1 |
| [11] |
Łuczyńska E, Heinze-Paluchowska S, Hendrick E, et al. Comparison between breast MRI and contrast-enhanced spectral mammography[J]. Medical Science Monitort, 2015, 21: 1358-1367. DOI:10.12659/MSM.893018 |
| [12] |
Rudnicki W, Heinze S, Niemiec J, et al. Correlation between quantitative assessment of contrast enhancement in contrast-enhanced spectral mammography (CESM) and histopathology-preliminary results[J]. Europe Radiology, 2019, 29(11): 6220-6226. DOI:10.1007/s00330-019-06232-6 |
| [13] |
Badr S, Laurent N, Régis C, et al. Dual-energy contrast-enhanced digital mammography in routine clinical practice in 2013[J]. Diagnostic and Interventional Imaging, 2014, 95(3): 245-258. DOI:10.1016/j.diii.2013.10.002 |
| [14] |
Patel B K, Hilal T, Covington M, et al. Contrast-enhanced spectral mammography is comparable to mri in the assessment of residual breast cancer following neoadjuvant systemic therapy[J]. Annals of Surgical Oncologyl, 2018, 25(5): 1350-1356. DOI:10.1245/s10434-018-6413-x |
| [15] |
姜婷婷, 张盛箭, 李瑞敏, 等. 对比增强能谱X线摄影对乳腺疾病的诊断价值[J]. 中华放射学杂志, 2017, 51(4): 273-278. DOI:10.3760/cma.j.issn.1005?1201.2017.04.008 |
| [16] |
Bhimani C, Matta D, Roth R G, et al. Contrast-enhanced spectral mammography:technique, indications, and clinical applications[J]. Academic Radiology, 2016, 24(1): 84. |
| [17] |
Vera F, Felix D, Diane M, et al. Correlation of contrast agent kinetics between iodinated contrast-enhanced spectral tomosynthesis and gadolinium-enhanced MRI of breast lesions[J]. European Radiology, 2013, 23(6): 1528-1536. DOI:10.1007/s00330-012-2742-5 |



