纳米生物复合物是指由纳米尺寸的无机组分和生物大分子结合在一起形成的新一代的纳米结构生物杂化材料[1]。纳米生物复合材料兼具了生物大分子选择催化、识别的特性和纳米材料电子、光电子和催化性能,是一种新型的生态材料,已成为快速发展的新研究领域[2]。明胶是胶原经过酸式或碱式水解得到的热变性的纤维状蛋白质分子,广泛存在于动物的骨和皮中,是最早商品化的蛋白质[3]。明胶无毒,容易成膜,具有极好的溶胀和吸水性能、生物相容性以及生物降解性[4]。作为一种天然生物大分子,明胶广泛应用于食品加工、电化学、生物医学、制药以及组织工程等领域[5,6]。明胶分子中含有许多官能团(双键、—NH2、—SH和 —COOH)[7]复合材料理想的生物模板,近年来在纳米材料制备方面的应用受到越来越多的科研工作者的青睐。以明胶为包覆剂和稳定剂制备无机纳米材料的方法被称为是简单的和“绿色”的方法[8]。
金属硫化物具有优异的电学、光学和磁学特性,因此可以应用于光电转换、光催化、光发射二极管、太阳能电池、生物荧光探针等领域[9,10]。金属硫化物体系中,硫化铁是一个非常复杂的体系,当Fe和S的化学计量比以及硫化铁纳米材料晶体结构不同时,这些材料会表现出独特的电学和磁学性质[11],这些性质决定了硫化铁纳米材料将被广泛应用于高能量密度电池和太阳能光电材料。
明胶与Fe3+的相互作用已见诸文献[12,13]。以明胶水溶液为介质,用金属盐溶液与含硫化合物(Na2S、硫代乙酰胺和H2S等)合成纳米金属硫化物亦有文献报道(CuS、ZnS[14]、Ag2S[15]、HgS[16]、PbS[17]、CdS[18]),但迄今为止,所有有关明胶/无机纳米材料的研究都集中在材料的制备、表征和新颖功能的开发方面[19],明胶基纳米复合材料形成反应的热力学特征和反应过程中明胶构象变化等则鲜见报道。
鉴于此,本文在pH=7.40条件下采用一锅化学反应法合成了明胶/Fe2S3纳米生物复合物溶液;利用紫外-可见光谱研究了键合反应的热力学特征;利用红外光谱研究了结合位点和明胶蛋白质的构象变化;初步推测了反应机理;结合扫描电镜技术,研究了Fe2S3颗粒形貌。研究结果不仅为该类纳米材料的制备和安全应用提供了理论依据,也为建立纳米材料安全评价体系积累了必要的实验数据。 1 实验部分 1.1 试剂和仪器
明胶(CP,Type B,上海化学试剂分装厂,SDS凝胶电泳法测得分子量约为100 kDa);FeCl3·6H2O(AR,汕头市光华化学厂);Na2S·9H2O(AR,成都市科龙化工试剂厂);盐酸和NaOH(AR,国药集团化学试剂有限公司);实验用水为二次蒸馏水。
2802 PCS型紫外-可见吸收光谱仪(尤尼柯,上海);AS-21P型恒温自动控制器(尤尼柯,上海);500Ⅱ型傅立叶红外分光光度计(美国Nicolet);PHS-3D功能型pH计(上海三信仪表厂);S-4800型扫描电子显微镜(日本Hitachi)。 1.2 实验方法
准确量取浓度为1.25×10-4 mol·L-1的明胶溶液1.00×10-2 L,分别置于2.50×10-2 L 的烧杯中,加入不同体积的浓度为1.00×10-3 mol·L-1的Fe3+离子溶液,搅拌均匀,在酸度计检测下,用HCl和NaOH稀溶液调节溶液pH值为7.40;再在各个烧杯中加入浓度为0.10 mol·L-1的S2-离子溶液5.00×10-4 L,搅拌均匀,调节溶液pH为7.40;将溶液转移到2.50×10-2 L的比色管中,用pH为7.40的水定容至刻度。即得到明胶和S2-浓度不变、Fe3+浓度不同的系列溶液。将样品溶液保持在测试温度下的恒温水浴中平衡10 h,以备后续的紫外测试。
用2802 PCS紫外-可见吸收光谱仪测定体系的紫外-可见吸收光谱,扫描范围190~800 nm。将样品浓缩得固体样品,测定其红外光谱。用扫描电子显微镜观察纳米颗粒的形貌。 2 结果与讨论 2.1 明胶/Fe2S3的扫描电镜照片
图1为样品溶液的扫描电镜照片。由图可知:在pH=7.40的明胶溶液中形成的Fe2S3颗粒为棒状,颗粒的平均粒径为139 nm,平均长度为1160 nm。实验条件下所制备的明胶/Fe2S3溶液室温放置5天,无沉淀生成,这与水溶性的明胶大分子对纳米颗粒表面进行了化学修饰有关。按实验方法制备水溶性纳米材料,方法简便,可操作性强。
 | 图1 明胶/Fe2S3溶液的SEM照片 SEM image of gelatin/Fe2S3 [gelatin]=5.00×10-5 mol·L-1,[Fe3+]=1.00×10-4 mol·L-1 and [S2-]=2.00×10-3 mol·L-1 |
实验测得明胶蛋白质的红外特征峰位置分别为:2926.49 cm-1(酰胺B带:CH2—的反对称伸缩振动),1631.33 cm-1(酰胺Ⅰ带:CO或反对称羧基伸缩振动),1543.71 cm-1(酰胺Ⅱ带:C—N伸缩或N—H弯曲振动)和1245.60 cm-1(酰胺Ⅲ带:主要是C—N伸缩振动)[20,21,22,23]。加入Fe3+后CO伸缩振动频率降低至1625.44 cm-1,而C—N和N—H混频(主要是N—H弯曲振动)的振动频率升高至1555.26 cm-1,表明Fe3+与明胶大分子的酰胺键结合,碳和氧原子间的电子云密度向氧原子方向移动,从而导致羰基的振动频率减小,C—N和N—H混频的振动频率升高[24]。考虑到Fe3+电荷/离子半径比高,球形对称,主要与以氧为配位原子的基团形成稳定配合物[25],故可推测,Fe3+主要与酰胺键的氧结合形成明胶/Fe3+复合物,但不能排除其与氮结合的可能。441.45 cm-1处出现新峰,进一步证明复合物的形成。与明胶/Fe3+相比,加入Na2S后,C=O伸缩振动频率升高至1631.40 cm-1,而C—N和N—H混频的振动频率变化不大(1554.96 cm-1),并在438.05 cm-1处出现新峰,与黄铁矿的伸缩振动特征峰411.97 cm-1位置接近[26],说明生成了明胶/Fe2S3复合物。另外,明胶/Fe3+和明胶/Fe2S3的生成对明胶大分子的构象产生了微扰(明胶的CH2—反对称伸缩振动由2926.49 cm-1变化为2928.02 cm-1和2926.53 cm-1,弯曲振动由1446.44 cm-1变化为1443.01 cm-1和1445.76 cm-1)。 2.3 明胶、明胶/Fe3+、明胶/Fe2S3和Fe2S3溶液的紫外-可见吸收光谱
图2是以pH=7.40的水为参比,测得的明胶、明胶/Fe3+、明胶/Fe2S3和Fe2S3溶液的紫外-可见吸收光谱。由图可看出,明胶在230 nm附近有一强吸收峰,280 nm附近有一较强的吸收肩峰,在320~800 nm范围内无吸收。230 nm附近的吸收主要是由明胶肽键CO基的π-π*跃迁所引起的,与明胶的α-螺旋含量有关;280 nm附近的吸收是由芳香氨基酸残基π-π*跃迁产生的[27]。与明胶的紫外-可见吸收光谱相比,明胶/Fe3+的紫外-可见吸收光谱在230和280 nm的位置吸光度都有所增强,表明Fe3+与明胶结合,导致明胶蛋白的结构发生变化,疏水腔中的色氨酸(Trp)和酪氨酸(Try)等芳香氨基酸残基所处的微环境发生改变,逐渐暴露,Trp吲哚环上的氮和Try酚基上的氧亲水性增强,与带正电荷的Fe3+作用,使芳香氨基酸残基π-π*跃迁能级降低,发生增色现象[28]。明胶/Fe2S3的紫外-可见吸收光谱在230和280 nm的位置吸光度也有所增加,且230 nm附近峰形变宽,说明S2-与原先配位状态的Fe3+形成了Fe2S3微粒,对明胶蛋白质的作用更为明显,使明胶肽链伸展程度更大,包围在明胶高分子链内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来的更多,表现为230 nm和280 nm的位置吸光度增加更为显著。插图为Fe2S3和明胶/Fe2S3体系吸收峰的局部放大图,可以明显的看出Fe2S3溶液的吸收峰位于394 nm和615 nm处,而明胶/Fe2S3溶液的吸收峰位于430 nm和630 nm处,这说明S2-与结合在明胶分子上的Fe3+键合生成了Fe2S3微粒。
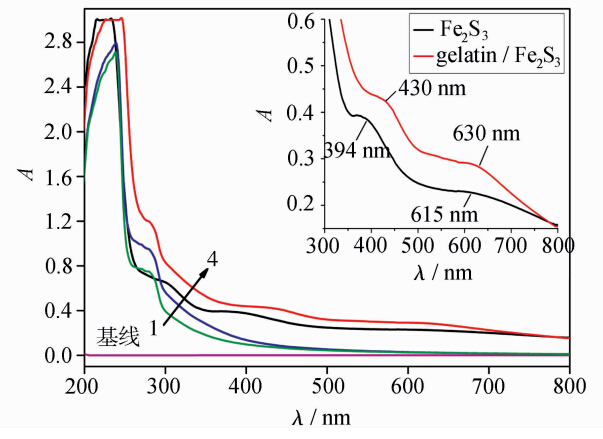 | 图2 明胶(1)、明胶/Fe3+(2)、Fe2S3(3)和 明胶/Fe2S3(4)的紫外-可见吸收光谱 The UV-Vis absorption spectra of gelatin (1),gelatin/Fe3+ (2), Fe2S3 (3) and gelatin/Fe2S3(4) [gelatin]=5.00×10-5 mol·L-1,[Fe3+]=1.00×10-4 mol·L-1 and [S2-]=2.00×10-3 mol·L-1 |
纳米微粒与蛋白质的结合往往伴随着蛋白质二级结构的明显改变,这方面的研究对于探讨纳米颗粒生物学效应的本质尤为重要。酰胺Ⅰ带(1600~1700 cm-1)经常被用于研究蛋白质的构象变化[29],为了进一步分析明胶二级结构的变化情况,利用去卷积方法对酰胺Ⅰ带进行拟合并结合文献中对明胶中各子峰的归属(1646~1661 cm-1为α-螺旋结构,1610~1637 cm-1和1682~1698 cm-1为β-折叠结构,1661~1681 cm-1为β-转角结构,1637~1645 cm-1为无规卷曲结构[30,31])得图3和表1。
| 表1 明胶、明胶/Fe3+和明胶/Fe2S3红外光谱子峰的归属及面积百分含量 Secondary structure analyses (infrared spectra) from the gelatin, gelatin/Fe3+ and gelatin/Fe2S3 |
由图3和表1可知,纯明胶中包含四种结构:α-螺旋、β-折叠、β-转角和无规卷曲。与纯明胶相比,明胶/Fe3+和明胶/Fe2S3复合物中明胶二级结构的α-螺旋和无规卷曲含量均减少,β-折叠含量明显增加。α-螺旋含量减少说明Fe3+和形成的Fe2S3微粒与明胶大分子肽链结合,削弱或破坏了氢键[32],导致蛋白质骨架松散和伸展,明胶微环境的疏水性减弱以及明胶二级结构改变(二级结构由α-螺旋向β-折叠转变),这与紫外光谱的分析结果是一致的。
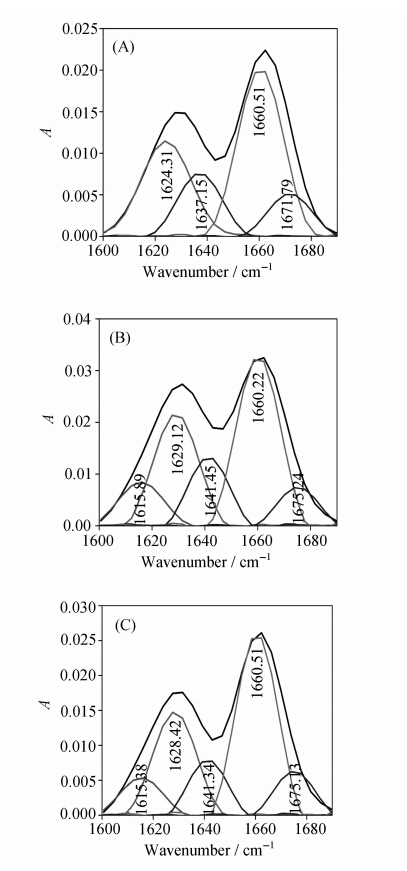 | 图3 明胶(A)、明胶/Fe3+(B)和明胶/Fe2S3(C)酰胺Ⅰ带的红外去卷积拟合图 The deconvolution curve-fitting figures of amide Ⅰ band of gelatin (A),gelatin/Fe3+ (B) and gelatin/Fe2S3 (C) from FT-IR spectra |
综合紫外光谱、红外光谱以及红外光谱去卷积拟合的分析结果可推测,明胶/Fe2S3复合物的形成可能包括两个阶段[33]:首先Fe3+和明胶大分子肽链中酰胺键发生作用形成明胶/Fe3+复合物,这个过程中明胶是结构导向剂和氧的来源。随着Na2S的加入,S2-与已经结合在明胶分子上的Fe3+作用生成Fe2S3微粒,这一步中明胶作为包覆剂对降低成核作用的活化能起着重要的作用。类似现象在HgS纳米晶体的仿生合成[32]、CdS/BSA纳米复合物的合成[34]、PbS纳米立方体的仿生合成[35]以及明胶溶液中笤帚状纳米CdS的合成中都有报道[24]。该机理可用以下示意图表示(以羰基的结合为例)。
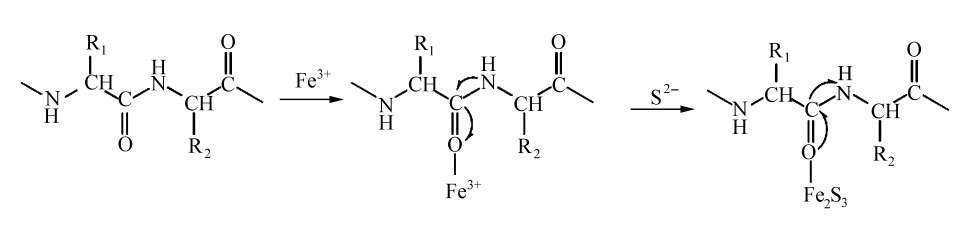 | 式1 明胶/Fe2S3纳米生物复合物的形成机理 Schematic representation of the formation of gelatin/Fe2S3 bionanocomposites |
图4为以纯明胶溶液为参比,不同浓度明胶/Fe2S3溶液的紫外-可见吸收光谱,其中1#为参比。由图4可看出,明胶/Fe2S3体系在430 nm处有强吸收峰,在622 nm处有一肩峰。以430 nm处复合物的吸光度对Fe2S3浓度作图(见图中插图),良好的直线关系说明体系在此处的吸光度与Fe2S3浓度之间符合Beer-Lambert 定律。其它温度下亦有直线关系(297 K,R=0.9961;309 K,R=0.9988)。
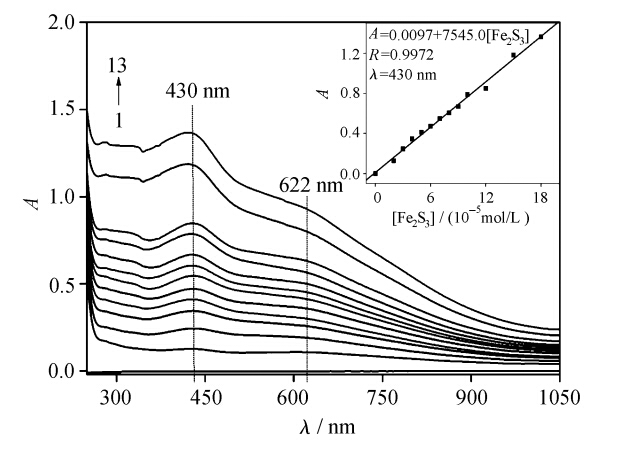 | 图4 明胶/Fe2S3体系的紫外-可见吸收光谱(293 K) UV-Vis spectra of gelatin/Fe2S3 system (293 K) [gelatin]=5.00×10-5mol·L-1;[Fe2S3]/(10-4mol·L-1) corresponding to 113: 0.00,0.20,0.30,0.40,0.50,0.60, 0.70,0.80,0.90,1.00,1.20,1.50,1.80 |
明胶/Fe2S3复合物的形成反应可由式(1)给出,其中K为表观形成常数:
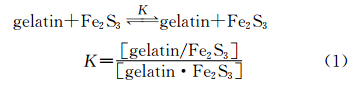
Benesi-Hildebrand方程(式(2))[37]已被用于研究一些无机纳米颗粒如Ag[38]、CdS[39]、ZnO[40]、AgTiO2[41]等与牛血清白蛋白的结合反应。
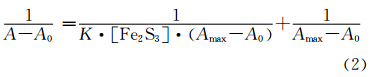
以(A-A0)-1对[Fe2S3]-1作图见图5。式中A为不同Fe2S3浓度下明胶/Fe2S3溶液的吸光度;A0为纯明胶的吸光度;Amax为最大Fe2S3浓度下明胶/Fe2S3溶液的吸光度;[Fe2S3]为Fe2S3浓度。由直线的斜率和截距求得各温度下反应的表观形成常数K列于表2。
表观形成常数K,可看作为明胶/Fe2S3复合物生成反应的平衡结果[41],因而可引入Van 't Hoff 公式(3),用以得到过程中的焓变(ΔrHm)与熵变(ΔrSm);当温度变化不大时,反应的焓变 ΔrHm可看成一个常数,由式(3),以lnK对1/T进行线性拟合,得直线方程为:lnK=-35.997+12698.009/T,R=0.9996;根据拟合结果求得ΔrHm和ΔrSm,进而由式(4)计算出反应的Gibbs自由能变ΔrGm亦列于表2。
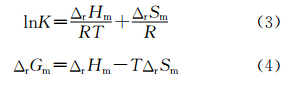
式中,R为气体常数,T为绝对温度,K为对应温度下的形成常数,ΔrHm为焓变,ΔrSm为熵变。
 | 图5 不同温度下的(A-A0)-1对[Fe2S3]-1作图 The plots of (A-A0)-1 vs [Fe2S3]-1 at different temperatures |
表2数据显示,反应的ΔrGm和ΔrHm均为负值,说明该反应是自发和放热的,且为焓驱动。ΔrSm为负值的原因可解释为:大量的S2-、Fe3+和明胶键合生成明胶/Fe2S3复合物,体系中总的分子数目减少[42];明胶蛋白质采取特定的构象以有利于Fe2S3的成核,以及包覆在颗粒表面以增强其在水中的稳定性,从而损失了可观的构象熵[43,44]。另外,ΔrHm小于零,表明Fe3+与明胶、S2-与明胶/Fe3+之间静电作用力较强,这有利于反应的进行[29]。
| 表2 明胶和Fe2S3键合反应的形成常数和热力学参数 Formation constants and thermodynamic parameters of the gelatin and Fe2S3binding reaction |
采用一锅化学反应法制得水溶性的明胶/Fe2S3纳米生物复合物,复合物稳定性较好;红外光谱表明形成的复合物中Fe2S3主要与明胶肽链中酰胺键发生作用;红外光谱去卷积结果表明,Fe2S3与明胶的结合改变了明胶的二级结构;明胶/Fe2S3纳米生物复合物的形成机理可描述为:Fe3+和明胶大分子肽链中酰胺键发生作用形成明胶/Fe3+络合物,S2-与已经结合在明胶分子上的Fe3+反应生成Fe2S3微粒即明胶/Fe2S3纳米生物复合物;计算反应的热力学参数,结果表明:该反应是自发的放热过程,且为焓驱动。
| [1] | Darder M, Aranda P, Ruiz-Hitzky E. Bionanocomposites: a new concept of ecological, bioinspired, and functional hybrid materials[J]. Advanced Materials, 2007, 19(10):1309-1319. |
| [2] | Katz E, Willner I. Integrated nanoparticle-biomolecule hybrid systems: synthesis, properties, and applications[J]. Angewandte Chemie International Edition, 2004, 43(45): 6042-6108. |
| [3] | 纪 云,张晓红,郭 荣. 明胶和阳离子表面活性剂CTAB的相互作用[J].化学学报, 2004, 62(4): 345-350. Ji Y, Zhang X H, Guo R. Interaction between gelatin and cationic surfactant CTAB[J]. Acta Chimica Sinica, 2004, 62(4): 345-350. |
| [4] | Dubruel P, Unger R, Vlierberghe S V, Cnudde V, Jacobs P J S, Schacht E, Kirkpatrick C J. Porous gelatin hydrogels: 2 in vitro cell interaction study[J]. Biomacromolecules, 2007, 8(2): 338-344. |
| [5] | Ge Y, Wang J L, Shi Z X, Yin J. Gelatin-assisted fabrication of water-dispersible and its inorganic analogues[J]. Journal of Materials Chemistry, 2012, 22:17619-17624. |
| [6] | Akbulut M, Reddy N K, Bechtloff B, Koltzenburg S, Vermant J, Prud'homme R K. Flow-induced conformational changes in gelatin structure and colloidal stabilization[J]. Langmuir, 2008, 24(17): 9636-9641. |
| [7] | Liu Y, Liu X H, Wang X. Biomimetic synthesis of gelatin polypeptide-assisted noble-metal nanoparticles and their interaction study[J]. Nanoscale Research Letters, 2010, 6: 22-32. |
| [8] | Virkutyte J, Varma R S. Green synthesis of metal nanoparticles: biodegradable polymers and enzymes in stabilization and surface functionalization[J]. Chemical Science, 2011, 2(5): 837-846. |
| [9] | Sharma S N, Sharma H, Singh G, Shivaprasad S M. Low energy ion induced effects on TOPO capped CdSe nanocrystals probed by XPS depth profiling and optical measurements[J]. Nuclear Instruments and Methods in Physics Research Section B: Beam Interactions With Materials and Atoms, 2006, 244(1): 86-90. |
| [10] | 周 锋, 马 强, 唐亚平, 张世骥, 李辰砂, 梁彤祥. 硫化镉纳米粒子的制备[J]. 材料工程, 2004, (10): 42-45. Zhou F, Ma Q, Tang Y P, Zhang S J, Li C S, Liang T X. Preparation of nano-particle of CdS[J]. Journal of Mate-rials Engineering, 2004, (10): 42-45. |
| [11] | Han W, Gao M Y. Investigations on iron sulfide nano-sheets prepared via a single-source precursor approach[J]. Crystal Growth Design, 2008, 8(3): 1023-1030. |
| [12] | 张宜恒, 李 洁, 闫天堂,俞书勤,庄思永,彭必先. 外来杂质Fe3+与照相明胶相互作用的研究[J]. 化学物理学报, 1999, 12(3): 326-332. Zhang Y H, Li J, Yan T T, Yu S Q, Zhuang S Y, Peng B X. Study on the interaction between doped ferric ion and photographic gelatin[J]. Chinese Journal of Chemical Physics, 1999, 12(3): 326-332. |
| [13] | 唐世华, 黄建滨. Cu2+和Fe3+与明胶的相互作用[J]. 物理化学学报, 2001, 17(10): 873-878. Tang S H, Huang J B. Study on interaction of gelatin with Cu2+ and Fe3+[J]. Acta Physico-Chimica Sinica, 2001, 17(10): 873-878. |
| [14] | Sugimoto T, Chen S H, Muramatsu A. Synthesis of uniform particles of CdS, ZnS, PbS and CuS from concentrated solutions of the metal chelates[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 1998, 135(1-3): 207-226. |
| [15] | Li Z, Zheng T, Chen L J, Peng B X, Yang L. Synthesis of Ag2S nano-sized clusters and their chemical sensitizations in AgCl cubic and {100} tabular microcrystal imaging systems[J]. Science in China Series B: Chemistry, 2005, 48(6): 516-522. |
| [16] | 唐世华, 黄在银. 明胶溶液中针状纳米HgS的仿生合成[J]. 影像科学与光化学, 2008, 26(3): 200-205. Tang S H, Huang Z Y. Biomimetic synthesis of acicular nanometer HgS in the gelatin solution[J]. Imaging Science and Photochemistry, 2008, 26(3): 200-205. |
| [17] | Mozafari M, Moztarzadeh F. Controllable synthesis, characterization and optical properties of colloidal PbS/gelatin core-shell nanocrystals[J]. Journal of Colloid and Interface Science, 2010, 351(2): 442-448. |
| [18] | Ovchinnikov O V, Smirnov M S, Shapiro B I, Latyshev A N, Shatskikh T S, Bordyuzha E E, Soldatenko S A.Spectral characteristics of CdS quantum dots and gelatin[J]. Theoretical and Experimental Chemistry, 2012, 48(1): 48-53. |
| [19] | Dickerson M B, Sandhage K H, Naik R R. Protein- and peptide-directed syntheses of inorganic materials[J]. Chemical Reviews, 2008, 108(11): 4935-4978. |
| [20] | Jung C. Insight into protein structure and protein-ligand recognition by fourier transform infrared spectroscopy [J]. Journal of Molecular Recognition, 2000, 13(6):325-351. |
| [21] | 严金龙, 聂福礼, 王肇福. 鞣性金属-明胶固体络合物的红外光谱[J]. 皮革化工, 1998, 15(4): 8-11. Yan J L, Nie F L, Wang Z F. Infrared spectra of solid complexes of gelatin and its tanning metal[J]. Leather Chemicals, 1998, 15(4): 8-11. |
| [22] | Staroszczyk H, Pielichowska J, Sztuka K, Stangret J, Kolodziejska I. Molecular and structural characteristics of cod gelatin films modified with EDC and TGase[J]. Food Chemistry, 2012, 130(2): 335-343. |
| [23] | Hoque M S, Benjakul S, Prodpran T. Effects of partial hydrolysis and plasticizer content on the properties of film from cuttlefish (sepia pharaonis) skin gelatin[J]. Food Hydrocolloids, 2011, 25(1): 82-90. |
| [24] | 唐世华, 黄在银, 黄建滨. 明胶溶液中笤帚状纳米CdS的合成及其光谱特性研究[J]. 化学学报, 2007, 65(15): 1432-1436. Tang S H, Huang Z Y, Huang J B. Synthesis and spectral properties of broom-like CdS nanoparticles in gelatin solution[J]. Acta Chimica Sinica, 2007, 65(15): 1432-1436. |
| [25] | 王 夔. 生命科学中的微量元素(第二版)[M]. 北京:中国计量出版社, 1996. 239. Wang K. Trace Elements in Life Sciences[M]. 2nd ed. Beijing: China Metrology Publishing House, 1996. 239. |
| [26] | 刘丽华, 张培萍, 李献洲. 金属硫化物矿物的远红外光谱表征[J]. 分析测试技术与仪器, 2006, 12(1): 34-37. Liu L H, Zhang P P, Li X Z. FTIR analysis of metallic sulfide minerals[J]. Analysis and Testing Technology and Instruments, 2006, 12(1): 34-37. |
| [27] | 陶慰孙, 李 惟, 姜涌明. 蛋白质分子基础(第二版)[M]. 北京:高等教育出版社, 1995. 254. Tao W S, Li W, Jiang Y M. Molecular Foundation of Protein [M]. 2nd ed. Beijing: Higher Education Press, 1995. 254. |
| [28] | Huang J, Yuan Y Z, Liang H. Binding equilibrium study of phosphotungstic acid and HSA or BSA with UV spectrum, fluorescence spectrum and equilibrium dialysis [J]. Science in China Series B: Chemistry, 2002, 45(2): 200-207. |
| [29] | Shen X C, Yuan Q, Liang H, Yan H G., He X W. Hysteresis effects of the interaction between serum albumins and silver nanoparticles[J]. Science in China Series B: Chemistry, 2003, 46(4): 388-398. |
| [30] | Magyari K, Baia L, Popescu O, Simion S, Simion V. The anchoring of fibrinogen to a bioactive glass investigated by FT-IR spectroscopy[J]. Vibrational Spectroscopy, 2012, 62: 172-179. |
| [31] | Saba R I, Ruysschaert J M, Herchuelz A, Goormaghtigh E. Fourier transform infrared spectroscopy study of the secondary and tertiary structure of the reconstituted Na+/Ca2+ exchanger 70-kDa polypeptide[J]. The Journal of Biological Chemistry, 1999, 274(22): 15510-15518. |
| [32] | 谢孟峡, 徐晓云, 王英典, 刘 媛. 4',5,7-三羟基二氢黄酮与人血清白蛋白相互作用的光谱学研究[J]. 化学学报, 2005, 63(22): 2055-2062. Xie M X, Xu X Y, Wang Y D, Liu Y. Spectroscopic investigation of the interaction between 2,3-dihydro-4',5,7-trihydroxyflavone and human serum albumin [J]. Acta Chimica Sinica, 2005, 63(22): 2055-2062. |
| [33] | Zhang L, Yang G R, He G X, Wang L, Liu Q R, Zhang Q X, Qin D Z. Synthesis of HgS nanocrystals in the lysozyme aqueous solution through biomimetic method[J]. Applied Surface Science, 2012, 258(20): 8185-8191. |
| [34] | Tang S H, Li Y Q, Wang J, Wang B Y. Optical properties of gelatin/CdS bionanocomposite and its conformational change[J]. Chinese Journal of Tissue Engineering Research, 2013, 17(34): 6166-6172. |
| [35] | Liang J G, Ai X P, He Z K, Xie H Y, Pang D W. Synthesis and characterization of CdS/BSA nanocomposites[J]. Materials Letters, 2005, 59(22): 2778-2781. |
| [36] | Qin D Z, Zhang L, He G X, Liu Q R. Biomimetic synthesis of PbS nanocubes in the lysozyme solution[J]. Materials Letters, 2012, 66(1): 7-9. |
| [37] | Benesi H A, Hildebrand J H. A spectrophotometric investigation of the interaction of iodine with aromatic hydrocarbons[J]. Journal of the American Chemical Society, 1949, 71(8): 2703-2707. |
| [38] | Manivel A, Anandan S. Spectral interaction between silica coated silver nanoparticles and serum albumins[J]. Colloids and Surfaces A: Physico-chemical and Enginee-ring Aspects, 2012, 395: 38-45. |
| [39] | Jhonsi M A, Kathiravan A, Renganathan R. Spectroscopic studies on the interaction of colloidal capped CdS nanoparticles with bovine serum albumin [J]. Colloids and Surfaces B: Biointerfaces, 2009, 72(2): 167-172. |
| [40] | Kathiravan A, Paramaguru G, Renganathan R. Study on the binding of colloidal zinc oxide nanoparticles with bovine serum albumin [J]. Journal of Molecular Structure, 2009, 934(1-3): 129-137. |
| [41] | Kathiravan A, Renganathan R, Anandan S. Interaction of colloidal AgTiO2 nanoparticles with bovine serum albumin [J]. Polyhedron, 2009, 28(1): 157-161. |
| [42] | Wang J, Tang S H, Wang B Y, Li Y Q. In-situ interaction of nano-PbS with gelatin[J]. Science China Chemistry, 2013, 56(11): 1593-1600. |
| [43] | Frederick K K, Marlow M S, Valentine K G, Wand A J.Conformational entropy in molecular recognition by proteins[J]. Nature, 2007, 448: 325-329. |
| [44] | Makhatadze G I, Privalov P L. On the entropy of protein folding[J]. Protein Science, 1996, 5(3): 507-510. |




