纳米生物复合物是指由无机纳米颗粒和生物大分子结合形成的处于纳米尺度的一种新兴复合材料[1, 2]。此类材料不仅具有无机纳米材料的机械和光电特性,还具有生物大分子选择催化和识别的特性,以及生物相容性和生物降解性,广泛应用于光电器件、食品包装、药物载体和再生医学等研究领域,已成为材料、化学和生物科学的发展前沿和研究热点[3, 4, 5, 6, 7]。
硫化锌(ZnS)是一种重要的宽禁带Ⅱ-Ⅵ族半导体材料,具有独特的光电性能、良好的热稳定性、红外透射率高和熔融温度高等特性,在发光材料、传感器、红外窗口材料及光催化等众多方面有着广泛的应用[8, 9, 10, 11, 12]。明胶是胶原经过水解后得到的一种天然无毒纤维状蛋白质,含有羧基、羰基、氨基和双键等官能团,其亲水性强、反应活性高,具有蛋白质类生物大分子的特性,是制备纳米生物复合材料理想的生物模板,已在食品加工、化妆品、生物医学和制药工程等领域得到广泛应用[13, 14, 15, 16]。明胶作为模板仿生合成金属硫化物纳米粒子已有文献报道[17, 18, 19],但相关报道主要集中在纳米生物复合物的制备、表征和新型功能开发方面[20],而较少关注纳米颗粒与生物大分子相互作用的热力学特征及反应过程中明胶构象变化[21, 22]。
鉴于此,我们开展了金属硫化物/明胶纳米生物复合物的合成及金属硫化物与明胶蛋白质相互作用的研究[23, 24, 25]。作为系列研究结果,本文在pH=7.40条件下采用一锅化学反应法合成了水溶性ZnS/明胶纳米生物复合物,利用透射电子显微镜、X射线粉末衍射、紫外-可见吸收光谱和傅里叶变换红外光谱对复合物进行了表征,利用荧光光谱研究了ZnS与明胶相互作用的热力学特征以及明胶的构象变化。
1 实验部分 1.1 试剂与仪器明胶(CP,上海化学试剂分装厂);ZnCl2(AR,汕头市光华化学厂);Na2S·9H2O(AR,成都市科龙化工试剂厂);HCl(AR,国药集团化学试剂有限公司);NaOH(AR,广州化学试剂厂);二次蒸馏水。
PHS-3D功能型pH计(上海三信仪表厂);JEM-1011透射电子显微镜(日本 JEOL);D/MAX 2500 X射线粉末衍射仪(日本 Rigaku);2802 PCS紫外-可见吸收光谱仪(上海 Unico);500Ⅱ傅里叶红外分光光度计(美国 Nicolet);LS-55荧光分光光度计(美国 Perkin Elmer);SCD-6节能型智能恒温槽(宁波新芝生物科技股份有限公司)。
1.2 样品制备准确移取浓度为1.25×10-4 mol/L的明胶溶液1.0×10-2 L,分别置于2.5×10-2 L的烧杯中,依次加入不同体积的浓度为0.010 mol/L的Zn2+溶液,在搅拌和pH计检测下,滴加NaOH或HCl稀溶液,调溶液pH值为7.40;再加入浓度为0.10 mol/L的S2-溶液5.0×10-4 L,混匀,调溶液pH值为7.40。将溶液转移至2.5×10-2 L的比色管中,用pH值为7.40的水溶液定容至刻度,即得到明胶和S2-浓度相同,Zn2+浓度不同的样品溶液。将样品溶液置于测试温度下恒温水浴20 h,使其充分平衡。
1.3 样品测试将样品溶液浓缩固化,采用KBr压片制样,利用500Ⅱ傅里叶红外分光光度计测定其红外光谱。用2802 PCS紫外-可见吸收光谱仪测定ZnS/明胶的紫外-可见吸收光谱,扫描范围190~800 nm。用LS-55荧光分光光度计测定ZnS/明胶的同步荧光光谱和三维荧光光谱,测定同步荧光光谱时,固定激发波长与发射波长的间距,使 Δλ=λem -λex=30 nm;测定三维荧光光谱时,扫描范围200~800 nm,扫描速度1200 nm/min,激发和发射的狭缝宽度为10 nm。
2 结果与讨论 2.1 ZnS/明胶纳米生物复合物的结构表征图 1(A)为明胶和ZnS/明胶的XRD图谱,从图中可以看出,明胶呈宽大的弥散峰,峰包中心2θ约在21°处,表明明胶蛋白为非晶态物质,不存在晶体结构;ZnS/明胶亦为弥散峰,没有显示出ZnS的特征衍射峰,说明ZnS与明胶发生了相互作用,ZnS颗粒被明胶大分子包覆。图 1B为ZnS/明胶的TEM照片,照片显示ZnS颗粒大多呈均匀的球形,平均粒径约为30 nm,插图为局部放大图,中心颜色较浅的为ZnS颗粒,颗粒边缘颜色较深的为明胶,说明明胶包覆了ZnS颗粒。将实验条件下制备的ZnS/明胶溶液室温放置一个月,无沉淀生成。这些均说明明胶大分子作为化学修饰剂和稳定剂,结合并包覆于ZnS颗粒表面,生成了ZnS/明胶纳米生物复合物[26]。
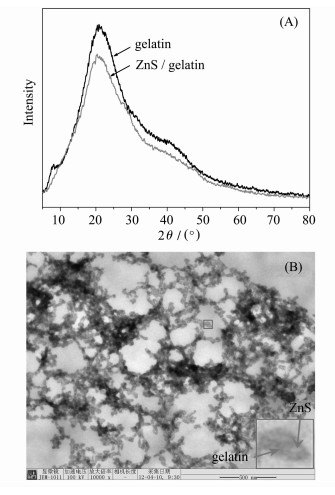 | 图1 ZnS/明胶的XRD图谱(A)和TEM照片(B) XRD pattern (A) and TEM image (B) of ZnS/gelatin |
紫外-可见吸收光谱可用于检测复合物的形成,是一种简单而有效的方法[27]。图 2是以pH=7.40的水溶液为参比,测得的明胶、Zn2+/明胶和ZnS/明胶的紫外-可见吸收光谱。由图可知,明胶在230 nm左右有一强吸收峰,280 nm附近有一个较强的吸收肩峰(曲线1),分别是由明胶肽键上CO的π-π*跃迁和明胶肽链的芳香族氨基酸残基(如酪氨酸、色氨酸、苯丙氨酸等)的π-π*跃迁引起的[28]。与明胶的吸收光谱相比,Zn2+/明胶的紫外吸收肩峰强度稍有增强(曲线2),表明Zn2+与明胶发生了相互作用;但ZnS/明胶的紫外吸收肩峰强度显著增强(曲线3),且最大吸收峰和肩峰都发生了明显的红移,吸收峰强度增强和红移是新物质形成的特征,说明加入的S2-与结合在明胶分子上的Zn2+键合生成了ZnS/明胶纳米生物复合物[29]。明胶大分子弯曲包覆于ZnS颗粒表面,引起芳香族氨基酸残基逐渐从明胶内部暴露出来,使明胶肽链伸展,降低了芳香族氨基酸残基π-π*跃迁所需的能量,导致吸收峰红移,吸收强度增强[30]。随着ZnS浓度的增大(曲线4),ZnS对明胶构象产生的影响更为明显,使明胶肽链伸展程度更大,芳香族氨基酸残基暴露的更多,因此紫外吸收肩峰的强度增强及红移更为显著。
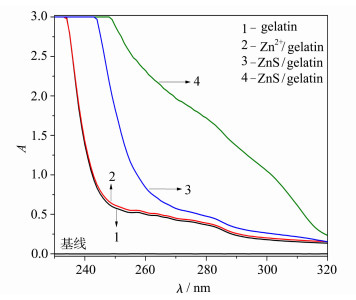 | 图2 明胶(1)、Zn2+/明胶(2)和ZnS/明胶(3, 4)的紫外-可见吸收光谱 UV-Vis spectra of gelatin (1), Zn2+/gelatin (2) and ZnS/gelatin (3, 4) Curves 1-4: [gelatin]=4.0 × 10-5 mol/L; [S2-]/(10-3 mol/L)=0.0, 0.0, 2.0, 2.0; [Zn2+]/(10-4 mol/L)=0.0, 1.0, 1.0, 10.0, respectively |
傅里叶变换红外光谱可以提供物质的化学组成及结构信息,已被用于研究蛋白质的结构特点[31]。图 3为明胶、Zn2+/明胶和ZnS/明胶的红外光谱。由图可知,明胶主要呈现具有蛋白质特征的酰胺带吸收,其特征峰为:1646 cm-1(酰胺Ⅰ带:CO伸缩振动)、1569 cm-1(酰胺Ⅱ带:C—N对称伸缩或N—H弯曲振动)、1264 cm-1(酰胺Ⅲ带:主要为C—N伸缩振动)和1399 cm-1(侧链—COO—对称伸缩)[32,33]。加入Zn2+后,明胶的特征峰分别位移至1638、1562、1255和1390 cm-1,表明Zn2+与明胶大分子上的酰胺基和羧基发生了作用,Zn2+与羰基氧结合,使碳原子和氧原子的电子云密度向氧原子方向移动,从而导致羰基的振动频率减小[34]。加入S2-后,明胶的特征峰又分别位移至1644、1571、1264和1401 cm-1,与Zn2+/明胶相比,羰基峰(酰胺Ⅰ带)的强度明显增强且振动频率增大,C—N和N—H混频(酰胺Ⅱ带)的振动频率也增大。由FT-IR吸收带频率的变化,可判断表面呈电正性的Zn2+与明胶分子中酰胺基的氮、氧原子,及羧基氧可能发生键合作用,生成了ZnS/明胶纳米生物复合物。此外,明胶在1446 cm-1(CH2—弯曲振动)的吸收峰,加入Zn2+后移至1448 cm-1,加入S2-后移至1450 cm-1,说明复合物的生成导致明胶构象发生了变化;明胶位于1646 cm-1的强酰胺Ⅰ带和位于1569 cm-1的酰胺Ⅱ带是其α-螺旋结构的特征振动,在与ZnS作用后,位移至1644和1571 cm-1,表明明胶分子产生了二级结构的变化,α-螺旋含量降低[35]。
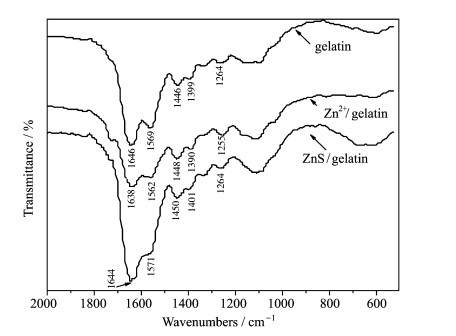 | 图3 明胶、Zn2+/明胶和ZnS/明胶的红外光谱 FT-IR spectra of gelatin, Zn2+/gelatin and ZnS/gelatin |
明胶主要因含有酪氨酸和荧光杂质而产生较强的荧光,同步荧光光谱通常被用于分析荧光基团所处的微环境,能反映出明胶的构象变化[36]。当 Δλ=30 nm时,同步荧光光谱能给出酪氨酸残基的特征信息[37]。图 4为Δλ=30 nm时ZnS/明胶的同步荧光光谱,插图为λ=282 nm处荧光强度与ZnS浓度的关系曲线。由图可知,ZnS的加入使明胶的荧光强度降低,且随着ZnS浓度的增大,ZnS对明胶荧光的猝灭作用越来越明显,并且酪氨酸特征荧光峰发生了红移(由282 nm红移至289 nm),表明明胶中酪氨酸残基所处的微环境发生了改变,酪氨酸残基从原来的疏水环境暴露至亲水环境中,亲水性增强,明胶的构象发生了改变[38],与紫外-可见吸收光谱的分析结果一致。
 | 图4 ZnS/明胶的同步荧光光谱(299 K) Synchronous fluorescence spectra of ZnS/gelatin at 299 K Curves 1-16: [gelatin]=4.00×10-5 mol/L; [ZnS]/(10-4 mol/L)=0.00, 0.04, 0.08, 0.10, 0.20, 0.30, 0.40, 0.50, 0.60, 0.80, 1.00, 2.00, 4.00, 8.00, 9.00, 10.00, respectively |
荧光猝灭机制可分为静态猝灭和动态猝灭,前者是由于猝灭剂与基态荧光分子结合生成一定构型的复合物而导致荧光强度减弱,后者是由于猝灭剂与激发态荧光分子碰撞而导致荧光强度减弱。Stern-Volmer方程[39]通常被用于分析荧光的猝灭机制:
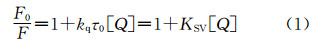
根据公式(1),以F0/F对ZnS浓度线性拟合,得到直线方程、相关系数(R)、KSV 和kq值列于表 1。由表 1可知,KSV值随着温度的升高而减小,且kq值远大于1010 L·mol-1·s-1,表明ZnS对明胶的荧光猝灭不是由碰撞引起的动态猝灭。结合紫外-可见吸收光谱和红外光谱结果,说明ZnS对明胶的荧光猝灭是由于生成了ZnS/明胶纳米生物复合物而引起的静态猝灭。
| 表1 不同温度下的Stern-Volmer直线方程、相关系数、猝灭常数和猝灭速率常数(Δλ=30 nm) Stern-Volmer regression equation, correlation coefficient, quenching constants and biomolecule quenching rate constants at different temperatures (Δλ= 30 nm) |
ZnS与明胶反应生成ZnS/明胶纳米生物复合物的反应式可表示为(G代表明胶):

根据修正的Scatchard方程[37]:
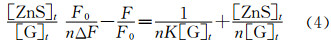
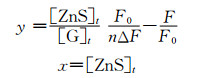
| 表2 不同温度下ZnS与明胶反应的生成常数、结合位点数和热力学参数(Δλ=30 nm) The formation constants, binding sites and thermodynamic parameters of gelatin with ZnS at different temperatures (Δλ=30 nm) |
当温度变化不大时,反应的焓变ΔrHm可看作一个常数,根据Vant′ Hoff方程(5)并结合前面得到的K值,以lnK对1/T作图,线性拟合得直线方程:
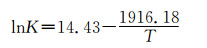
根据直线方程的斜率和截距分别得到反应的焓变ΔrHm和反应的熵变ΔrSm,再由热力学公式(6)计算出反应的Gibbs自由能变ΔrGm,见表 2。
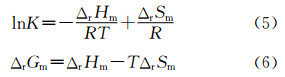
由表 2可知,n ≈1表明ZnS与明胶反应只有一类结合位点。ΔrGm <0,表明ZnS与明胶的键合反应是自发过程;ΔrHm >0表明反应是吸热的;ΔrSm >0表明反应为熵驱动,引起熵增大的原因可能是:
(1)ZnS与明胶结合生成ZnS/明胶纳米生物复合物,引起明胶构象发生变化,明胶α-螺旋含量降低,肽链更加伸展,体系混乱度增大[35];
(2)水化的明胶大分子、Zn2+和S2-在ZnS/明胶纳米生物复合物生成的同时,释放出大量的水分子,引起体系混乱度升高,熵值增大。
2.7 明胶和ZnS/明胶的三维荧光光谱三维荧光光谱提供的荧光信息全面而直观,因此广泛应用于蛋白质构象变化的研究[41]。图 5和图 6分别为明胶和ZnS/明胶的三维荧光光谱和轮廓光谱图,其特征参数列于表 3。
| 表3 明胶和ZnS/明胶的三维荧光光谱特征参数 Three-dimensional fluorescence spectral characteristics of gelatin and ZnS/gelatin |
 | 图5 明胶(A)和ZnS/明胶(B, C)的三维荧光光谱 Three-dimensional fluorescence spectra of gelatin (A) and ZnS/gelatin (B, C) A-C: [Gelatin]=4.0×10-5 mol/L; [ZnS]/(10-4 mol/L)=0.0, 1.0,10.0, respectively |
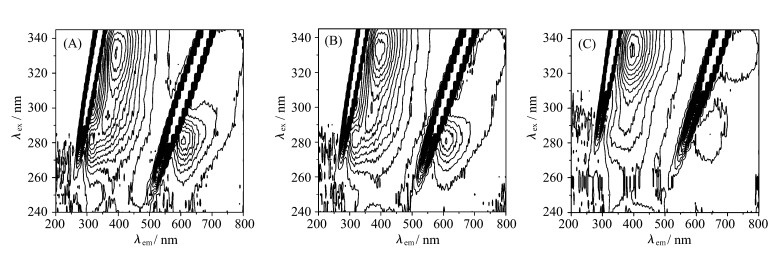 | 图6 明胶(A)和ZnS/明胶(B, C)的轮廓光谱图 Contour spectra of gelatin (A) and ZnS/gelatin (B, C) A-C: [Gelatin]=4.0×10-5 mol/L; [ZnS]/(10-4 mol/L)=0.0, 1.0,10.0, respectively |
由图 5可以直观地看出两个山脊形状的峰,这两个峰为瑞利散射峰(λex=λem)和二级瑞利散射峰(λem=2λex)[42],与图 6中铅笔状条纹相对应。图 5中的另外两个“驼峰”即峰1和峰2,分别对应图 6中的两组“指纹”线,峰1为明胶分子内未知荧光基团的荧光峰,峰2为酪氨酸残基的特征荧光峰[43]。在无ZnS和ZnS浓度为1.0×10-4 mol/L、1.0×10-3 mol/L时,峰1和峰2的荧光强度比分别为1.34∶1,1.81∶1和4.47∶1。当ZnS浓度为1.0×10-3 mol/L时,峰1的荧光强度稍有降低,而峰2的荧光强度显著降低,表明与ZnS结合后,明胶中酪氨酸残基所处的微环境发生了改变,明胶分子的结构遭到破坏,导致其构象发生了变化。
3 结论在pH=7.40条件下,纳米ZnS与明胶蛋白质直接键合生成了稳定性较好的ZnS/明胶纳米生物复合物。红外光谱表明ZnS与明胶中酰胺基的氮、氧原子及羧基氧可能发生键合作用。ZnS与明胶键合后导致明胶内源荧光猝灭,并引起了明胶构象的改变。由修正的Scatchard方程计算出的热力学参数表明ZnS与明胶的键合反应是自发的吸热过程,且为熵驱动。
| [1] | Nafchi A M, Nassiri R, Sheibani S, Ariffin F, Karim A A. Preparation and characterization of bionanocomposite films filled with nanorod-rich zinc oxide[J]. Carbohydrate Polymers, 2013, 96(1):233-239. |
| [2] | Darder M, Aranda P, Ruiz-Hitzky E. Bionanocomposites: a new concept of ecological, bioinspired, and functional hybrid materials[J]. Advanced Materials,2007, 19(10): 1309-1319. |
| [3] | Ruiz-Hitzky E. Progress in bionanocomposites: from green plastics to biomedical applications[J]. Progress in Polymer Science, 2013, 38(10-11): 1391-1391. |
| [4] | Nafchi A M, Moradpour M, Saeidi M, Alias A K. Thermoplastic starches:properties, challenges, and prospects[J]. Starch-Starke, 2013, 65(1-2):61-72. |
| [5] | Seok H, Park T H. Integration of biomolecules and nanomaterials: towards highly selective and sensitive biosensors[J]. Biotechnology Journal, 2011, 6(11): 1310-1316. |
| [6] | Katz E, Willner I. Integrated nanoparticle-biomolecule hybrid systems: synthesis, properties, and applications[J]. Angewandte Chemie (International Edition), 2004, 43(45): 6042-6108. |
| [7] | Dunlop J W C, Fratzl P. Biological composites[J]. Annual Review of Materials Research, 2010, 40(1): 1-24. |
| [8] | Hu J S, Ren L L, Guo Y G, Liang H P, Cao A M, Wan L J, Bai C L. Mass production and high photocatalytic activity of ZnS nanoporous nanoparticles[J]. Angewandte Chemie (International Edition), 2005, 44(8): 1269-1273. |
| [9] | Zhang Q Y, Su K, Chan-Park M B, Wu H, Wang D, Xu R. Development of high refractive ZnS/PVP/PDMAA hydrogel nanocomposites for artificial cornea implants[J]. Acta Biomaterialia, 2014, 10(3): 1167-1176. |
| [10] | Zhang S J. Preparation of controlled-shape ZnS microcrystals and photocatalytic property[J]. Ceramics International, 2014, 40(3): 4553-4557. |
| [11] | Fang X S, Zhai T Y, Gautam U K, Li L, Wu L M, Bando Y, Golberg D. ZnS nanostructures: from synthesis to applications[J]. Progress in Materials Science, 2011, 56(2): 175-287. |
| [12] | 刘海瑞, 方力宇, 贾伟, 贾虎生. ZnS纳米球的水热法制备及其光催化性能研究[J]. 无机化学学报, 2015, 31(3): 459-464. Liu H R, Fang L Y, Jia W, Jia H S. Fabrication of ZnS nanoparticles with enhanced photocatalytic activity by hydrothermal method[J]. Chinese Journal of Inorganic Chemistry, 2015, 31(3): 459-464. |
| [13] | Hoque M S, Benjakul S, Prodpran T. Effects of partial hydrolysis and plasticizer content on the properties of film from cuttlefish (Sepia pharaonis) skin gelatin[J]. Food Hydrocolloids, 2011, 25(1): 82-90. |
| [14] | Liu Y, Liu X H, Wang X. Biomimetic synthesis of gelatin polypeptide-assisted noble-metal nanoparticles and their interaction study[J]. Nanoscale Research Letters, 2011, 6(1): 22-32. |
| [15] | Ge Y, Wang J L, Shi Z X, Yin J. Gelatin-assisted fabrication of water-dispersible graphene and its inorganic analogues[J]. Journal of Materials Chemistry, 2012, 22(34): 17619-17624. |
| [16] | Staroszczyk H, Pielichowska J, Sztuka K, Stangret J, Kołodziejska I. Molecular and structural characteristics of cod gelatin films modified with EDC and TGase[J]. Food Chemistry, 2012, 130(2): 335-343. |
| [17] | Li Z, Zheng T, Chen L J, Peng B X, Yang L. Synthesis of Ag2S nano-sized clusters and their chemical sensitizations in AgCl cubic and {100} tabular microcrystal imaging systems[J]. Science in China Series B: Chemistry, 2005, 48(6): 516-522. |
| [18] | Mozafari M, Moztarzadeh F. Controllable synthesis, characterization and optical properties of colloidal PbS/gelatin core-shell nanocrystals[J]. Journal of Colloid and Interface Science, 2010, 351(2): 442-448. |
| [19] | Muradov M B, Nuriev M A, Eivazova G M. Electric conductivity of nanocompounds based on polymer and chalcogenide semiconductors CdS, Cu2S[J]. Surface Engineering and Applied Electrochemistry, 2007, 43(5): 391-394. |
| [20] | Dickerson M B, Sandhage K H, Naik R R. Protein- and peptide-directed syntheses of inorganic materials[J]. Chemical Reviews, 2008, 108(11): 4935-4978. |
| [21] | Jhonsi M A, Kathiravan A, Renganathan R. Spectroscopic studies on the interaction of colloidal capped CdS nanoparticles with bovine serum albumin[J]. Colloids and Surfaces B: Biointerfaces, 2009, 72(2): 167-172. |
| [22] | Shen X C, Yuan Q, Liang H, Yan H G., He X W. Hysteresis effects of the interaction between serum albumins and silver nanoparticles[J]. Science in China Series B: Chemistry, 2003, 46(4): 388-398. |
| [23] | 唐世华, 黄在银. 明胶溶液中针状纳米HgS的仿生合成[J]. 影像科学与光化学, 2008, 26(3): 200-205. Tang S H, Huang Z Y. Biomimetic synthesis of acicular nanometer HgS in the gelatin solution[J]. Imaging Science and Photochemistry, 2008, 26(3): 200-205. |
| [24] | 肖新光,黎幼群,唐世华. 纳米硫化钴与明胶蛋白质的原位键合作用研究[J]. 影像科学与光化学, 2011, 29(4): 297-305. Xiao X G, Li Y Q, Tang S H. Study on the in situ binding of nano-CoS to gelatin[J]. Imaging Science and Photochemistry, 2011, 29(4): 297-305. |
| [25] | 王白杨, 肖新光, 唐世华, 刘岑. 明胶/Fe2S3纳米生物复合物形成反应的热力学及明胶构象变化[J]. 影像科学与光化学, 2014, 32(6): 505-513. Wang B Y, Xiao X G, Tang S H, Liu C. The thermodynamics of gelatin/Fe2S3 bionanocomposites formation and gelatin conformational change[J]. Imaging Science and Photochemistry, 2014, 32(6): 505-513. |
| [26] | Ghosh S, Jiang W, McClements J D, Xing B S. Colloidal stability of magnetic iron oxide nanoparticles: influence of natural organic matter and synthetic polyelectrolytes[J]. Langmuir, 2011, 27(13): 8036-8043. |
| [27] | Ojha B, Das G. The interaction of 5-(alkoxy)naphthalen-1-amine with bovine serum albumin and its effect on the conformation of protein[J]. The Journal of Physical Chemistry. B, 2010, 114(11): 3979-3986. |
| [28] | Huang J, Yuan Y Z, Liang H. Binding equilibrium study of phosphotungstic acid and HSA or BSA with UV spectrum, fluorescence spectrum and equilibrium dialysis[J]. Science In China (Series B), 2002, 45(2): 200-207. |
| [29] | Yue Y Y, Chen X G, Qin J, Yao X J. A study of the binding of C.I. Direct Yellow 9 to human serum albumin using optical spectroscopy and molecular modeling[J]. Dyes and Pigments, 2008, 79(2): 176-182. |
| [30] | Zolghadri S, Saboury A A, Amin E, Moosavi-Movahedi A A. A pectroscopic study on the interaction between ferric oxide nanoparticles and human hemoglobin[J]. Journal of the Iranian Chemical Society, 2010, 7(Suppl. 2): S145-S153. |
| [31] | Yang X Z, Wu D C, Du Z L, Li R X, Chen X L, Li X H. Spectroscopy study on the interaction of quercetin with collagen[J]. Journal of Agricultural and Food Chemistry, 2009, 57(9): 3431-3435. |
| [32] | Jung C. Insight into protein structure and protein-ligand recognition by fourier transform infrared spectroscopy[J]. Journal of Molecular Recognition, 2000, 13(6): 325-351. |
| [33] | Vanea E, Magyari K, Simon V. Protein attachment on aluminosilicates surface studied by XPS and FTIR spectroscopy[J]. Journal of Optoelectronics and Advanced Materials 2010, 12(5): 1206-1212. |
| [34] | 张叔良, 易大年, 吴天明. 红外光谱分析与新技术[M]. 北京:中国医药科技出版社, 1993. 141. Zhang S L, Yi D N, Wu T M. Analysis and New Technology of Infrared Spectroscopy[M]. Beijing: The Medicine Science and Technology Press of China, 1993. 141. |
| [35] | 沈星灿, 刘新艳, 梁宏, 卢昕. 牛血红蛋白与银纳米粒子相互作用的光谱研究[J]. 化学学报, 2006, 64(6): 469-474. Shen X C, Liu X Y, Liang H, Lu X. Spectroscopic studies of interaction between bovine hemoglobin and Ag nanoparticles[J]. Acta Chimica Sinica, 2006, 64(6): 469-474. |
| [36] | Chen X, Fan J C, Wang Y, Fan C P, Shang Z C. Fluorometric study on the interaction between lomefloxacin and bovine lactoferrin[J]. Analytical Sciences, 2006, 22(3): 427-430. |
| [37] | 唐世华. 同步荧光光谱法研究明胶蛋白质与铜(Ⅱ)的相互作用[J]. 感光科学与光化学, 2005, 23(2): 102-107. Tang S H. Study of interaction between gelatin and copper (Ⅱ) using synchronours fluorescence spectroscopy[J]. Photographic Science and Photochemistry, 2005, 23(2): 102-107. |
| [38] | Shen X C, Liu X Y, Ye L P, Liang H, Wang Z Y. Spectroscopic studies on the interaction between human hemoglobin and CdS quantum dots[J]. Journal of Colloid and Interface Science, 2007, 311(2): 400-406. |
| [39] | Papadopoulou A, Green R J, Frazier R A. Interaction of flavonoids with bovine serum albumin: a fluorescence quenching study[J]. Journal of Agricultural and Food Chemistry, 2005, 53(1): 158-163. |
| [40] | 杨曼曼, 席小莉, 杨频. 用荧光猝灭和荧光加强两种理论研究喹诺酮类新药与白蛋白的作用[J]. 高等学校化学学报, 2006, 27(4): 687-691. Yang M M, Xi X L, Yang P. Studies on interaction of new medicine of quinolone class with HSA and BSA by using fluorescence enhancement and fluorescence quenching theory[J]. Chemical Journal of Chinese Universities, 2006, 27(4): 687-691. |
| [41] | Yue Y Y, Liu J M, Fan J, Yao X J. Binding studies of phloridzin with human serum albumin and its effect on the conformation of protein[J]. Journal of Pharmaceutical and Biomedical Analysis, 2011, 56(2): 336-342. |
| [42] | Zhang G W, Que Q M, Pan J H, Guo J B. Study of the interaction between icariin and human serum albumin by fluorescence spectroscopy[J]. Journal of Molecular Structure, 2008, 881(1-3): 132-138. |
| [43] | Ding F, Han B Y, Liu W, Zhang L, Sun Y. Interaction of imidacloprid with hemoglobin by fluorescence and circular dichroism[J]. Journal of Fluorescence, 2010, 20(3): 753-762. |




