表面等离子共振(Surface Plasmon Resonance,SPR)传感器作为一种灵敏有力的检测工具,可“实时”监测和分析不同的生物与化学物种[1-3]。它独特的对于低分子量化合物的表征与定量检测的能力,使它具有广泛的应用前景[4, 5],在诊断学、制药学、食品安全、环境监测以及国土安全等不同领域中发挥出强大的作用。 SPR传感器也是一种光学折射计,可用于测定SPR传感面上介质材料折射率的变化。这种传感器的工作原理是基于一种独特和简单的光学现象,即在其作为敏感部分的贵金属导带内,自由电子发生了集合的相干振荡。首先,这一振荡出现于金属/介电体的界面上,这是由于入射光(即电磁波)激发所引起的相互作用而发生的。这些由共振而建立起来的电荷密度的振荡,可称之为表面等离子激元(Surface Plasmon Polaritons,SPP)。然后,SPP就会形成一个按指数而衰减的电场,穿透进入到周围深度约几百纳米的介质中去。这一瞬时逝去的电场(evanescent field,倏逝场)高度敏感于周围介质折射率的变化,当敏感介质的折射率有所改变时,则用于激发SPR的入射光的特征(如:角度、波长、相位等)也会随之而变,于是它就可感知引起介质折射率变化的外来物种的存在,达到检测的目的。
SPR传感器有两种主要的类型:一为传播式的SPR(PSPR)[6],另一种则为局域式的SPR(LSPR)[7]。通常,PSPR是通过棱镜与光偶合,它是在连续的金属薄膜或光栅上激发,而共振则可沿着金属和介电体的界面传递,直到几百个微米处。LSPR是非传递式的表面等离子共振,它是在纳米结构金属表面上激发而引起的,LSPR共振可通过改变纳米结构的尺寸和形状以及组分等来加以调节[8]。所谓局域的表面等离子共振谱,可以说是一种有效的平台,用于检测接近于贵金属纳米颗粒表面处的分子折射指数的改变。 LSPR现象的出现,是因为光的入射波长与金属颗粒中的电子发生共振,进而引起金属纳米粒子的导带电子发生集合的振荡(collective oscillation),这可导致两个重要的结果:(1)引起集合振荡光波的波长可选择性地被纳米颗粒所吸收,于是就可通过紫外-可见光谱来加以监视,达到检测的目的;(2)可形成从纳米颗粒表面延伸出来的电磁场的增强,这一效应应当是与SERS表面增强光谱中所观察到的巨大增强相关的。
虽说LSPR传感器具有很好的光谱可调性,但它们的灵敏度比PSPR低。此外,无论是PSPR或LSPR传感器,都难以直接对极稀浓度(小于1 pmol/L)下或是很小分子量(小于8 Da)的物种进行检测。因此,提高SPR的灵敏度和选择性等就成为许多科学家所关心的课题[9, 10]。
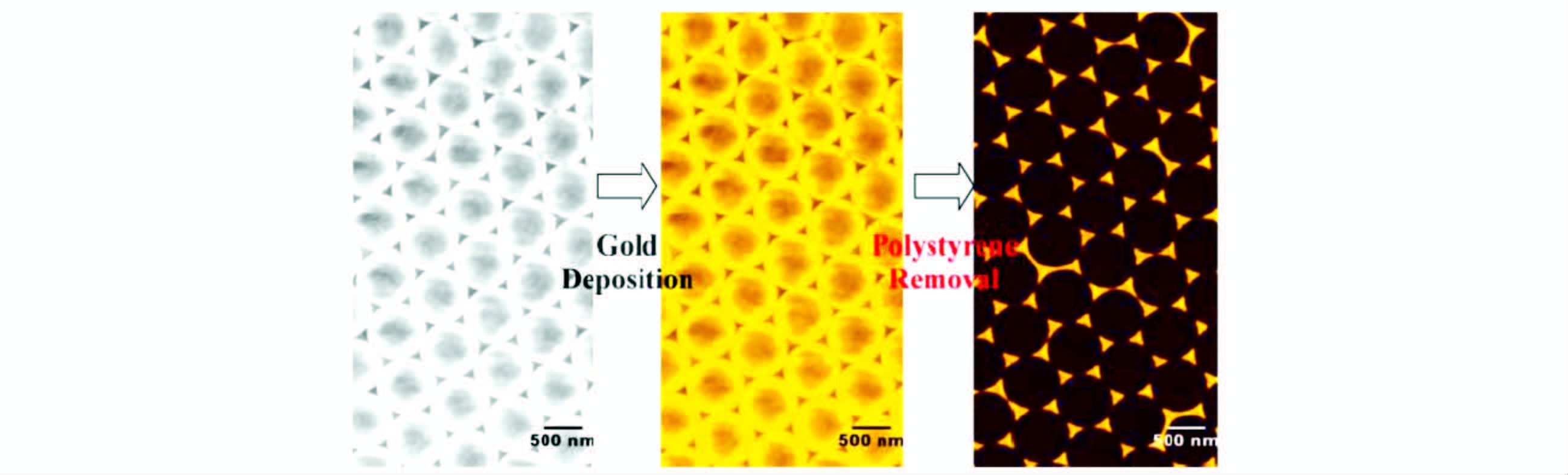
有关SPR金属传感膜的制作,从图 1和图 2中可以看出,PSPR的膜应当是较易制作的,这里仅对LSPR传感膜的制作作一简要的说明。在图 2B中可以看出,这种在玻璃基底上排列着的金属纳米锥体,一般是通过“纳米球刻蚀术”(Nanosphere Lithography,NSL)而制作出来的。实践证明这是一种相当好的制备方法[11-13],因为通过它可以得到大面积平行的、具有固定粒子间距的单分散金属纳米颗粒。制备方法简述如下:在经过认真清洁处理过的玻璃面上,将一定浓度和尺寸的单分散聚苯乙烯纳米小球的悬浮液滴加到玻璃表面,干燥后可得到纳米金属小球沉积模版紧密排列的六角形单层。将得到的模版放置于装有石英微量天平的金属气相沉积室内,可在金属的气相沉积过程中,对覆盖于模版上的金属膜厚度加以控制。在金属沉积后,可将样品置于甲醇中经超声洗涤3~5 min,以除去聚苯乙烯模版。此时,所得表面上的金纳米三角形锥体的垂直平分线将随所用聚苯乙烯纳米小球的直径D的变化而变化。至于所得纳米锥体的高度,则将随金属沉积量的多少而定[14]。 整个制备过程的阶段性结果如图 3所示。
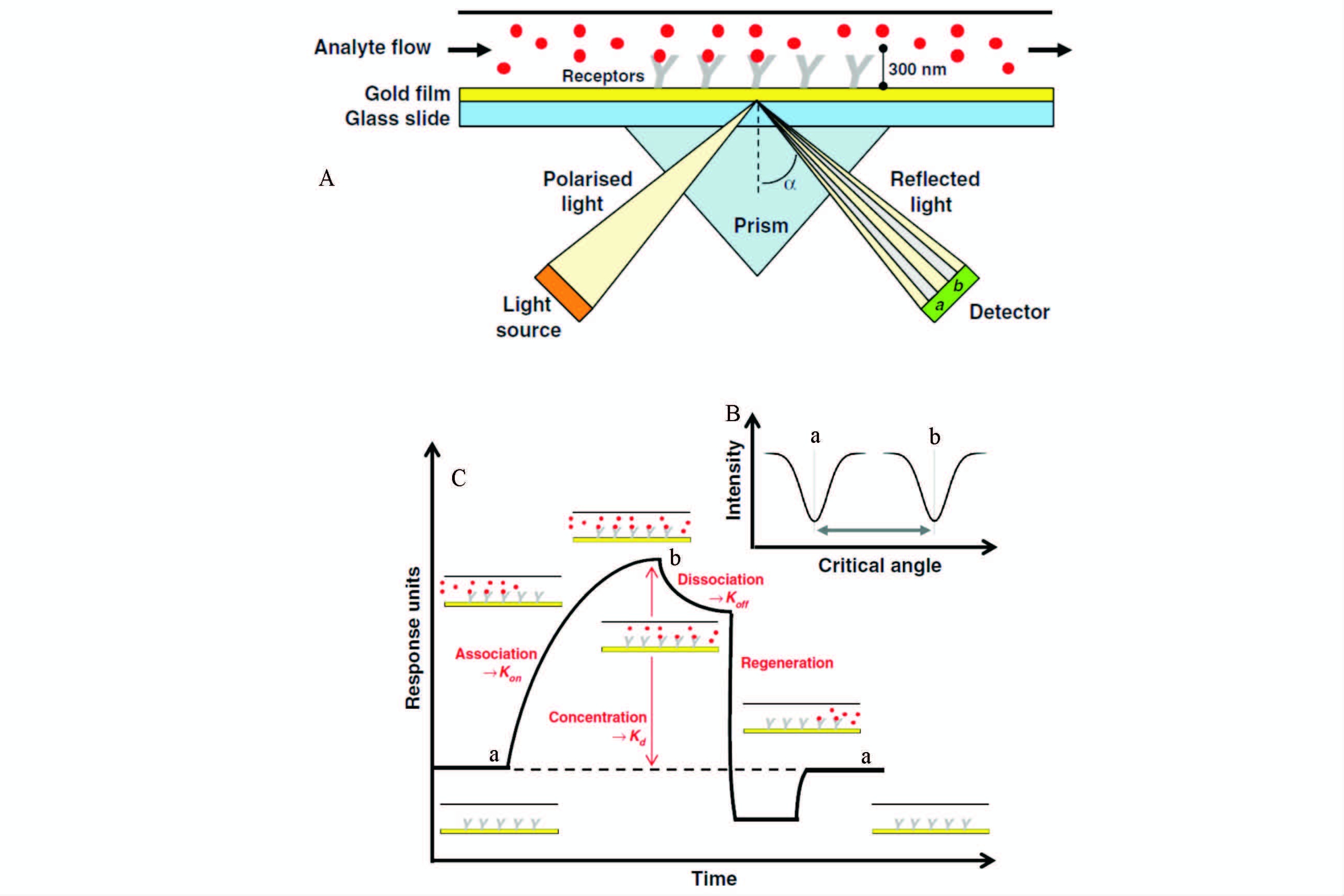
|
图 1 传播式PSPR 设备 (BIAcoreTM公司产品)的结构示意图及所得结果的图示 图 1C中的a,b分别为分析物与接收体结合过程与分解、恢复过程的起点 Fig.1 A structural representation for the prepagation type SPR (BIAcoreTM) (A) and the illstration of the obtained results(B and C) a and b in C are the starting points for the working process of combine and decompose between analyte and receptor,respectively |

|
图 2 局域式的LSPR设备的示意图(A和B)及所得结果(C) C为与分析物结合后所引起的共振峰位移[11] Fig.2 A schematic for the localized SPR set (LSPR) (A and B)and the obtained results(C) C is representative LSPR spectra representing the nanoparticle LSPR to combine with analyte before (OFF) and after (ON)[11] |
|
图 3 纳米球刻蚀术的过程 (左)为聚苯乙烯纳米颗粒沉积后形成的六角形单层图;(中)左图样品经金-气相沉积后的结果;(右)洗去聚苯乙烯后可得排布有金纳米锥体的传感膜片[15] Fig.3 The process for the nanosphere lithography (left) Deposition of polystyrene nanospheres to form hexagon monolayer on substrate,then after thermal evaporation of bulk gold (middle) and final removal of polystyrene spheres to leave triangular gold nanoparticles (right)[15] |
要对表面等离子共振(SPR)传感器作进一步改进,必须对等离子共振现象的成因及其光学、电子学的性质特征有较深入的了解。表面等离子共振(SPR)是在具有负的和正的介电常数的两种材料(一种为金属导体,一种为介电体)间、因金属导带中的自由电子经入射光的激发而引起的共振与振荡。只有当入射光子的频率与金属导带中自由电子对于正核的回复力所引起的自然振荡频率相匹配时方能引起共振。对具有纳米尺度的不同外形结构的LSPR,同样也要建立起一种等离子的、表面非辐射的等离子激元(surface plasmon polariton),由于它是处在导体与外部介质(例如空气或真空等)的边界上,因此这种振荡对边界上的一些任意变动十分敏感,例如金属导体或电介质对于外来分子的吸附,或是与外来分子发生了相互间的绑定反应(binding)等。
对于表面等离子激元的认识,最简单的方法是将两种材料都看作为均匀的、可以用金属与外部电介质间(或表面)频率依赖的相对介电常数来加以描述的一种连续体。相对介电常数也可称为材料的“介电函数”,是一个复数介电常数。当用“表面等离子激元”这一名词来描述电子表面共振,条件是金属导体介电常数的实数部分必须是负值,而它的数值大小必须要大于电介质的。这一条件只能在空气/金属、水/金属的界面上(这里,金属的实数介电常数是负的,而空气和水的则是正的),并在红外与可见光的范围内方能满足。因此表面等离子激元仅仅是在有正介电常数的材料与负介电常数材料的界面上方能存在。这种具有正介电常数的材料常被称为介电材料,它可以是任何透明的材料,诸如空气和(可见光的)玻璃等。而负介电常数材料则常被称为等离子材料,它们可以是金属或其他的材料。由于这些条件可对表面等离子共振的波长、吸收强度以及其他性质带来巨大影响,因此对它们的选定是十分重要的。
对于纳米尺度金属颗粒所构成的LSPR,其发展和人们的认识都是十分有趣的。长期以来,人们知道将贵金属族的纳米颗粒(如金银等)加入玻璃中可以得到漂亮有色的玻璃,早在公元四世纪时已经发现了所谓的Lycergus杯,就是将金或银的粉末混入玻璃中制得。法拉第曾将这种颜色归因于很细而分散的胶体金,或是今天我们所说的纳米金所致。但是当这种纳米颗粒的质地、尺寸与形状有所变化时,则观察到的颜色也会有所改变,如金的圆球有着特征性的红色,而银的圆球则是黄色的。近年来,许多研究显示,这种色调是由于电子电荷在导带上的集合振荡(collective oscillation of the electrons in the conduction band)即所谓的表面等离子振荡所引起的。亦即当入射光的电磁场与纳米颗粒表面上的电子振荡相匹配时,共振条件就达到了,如图 4所示。
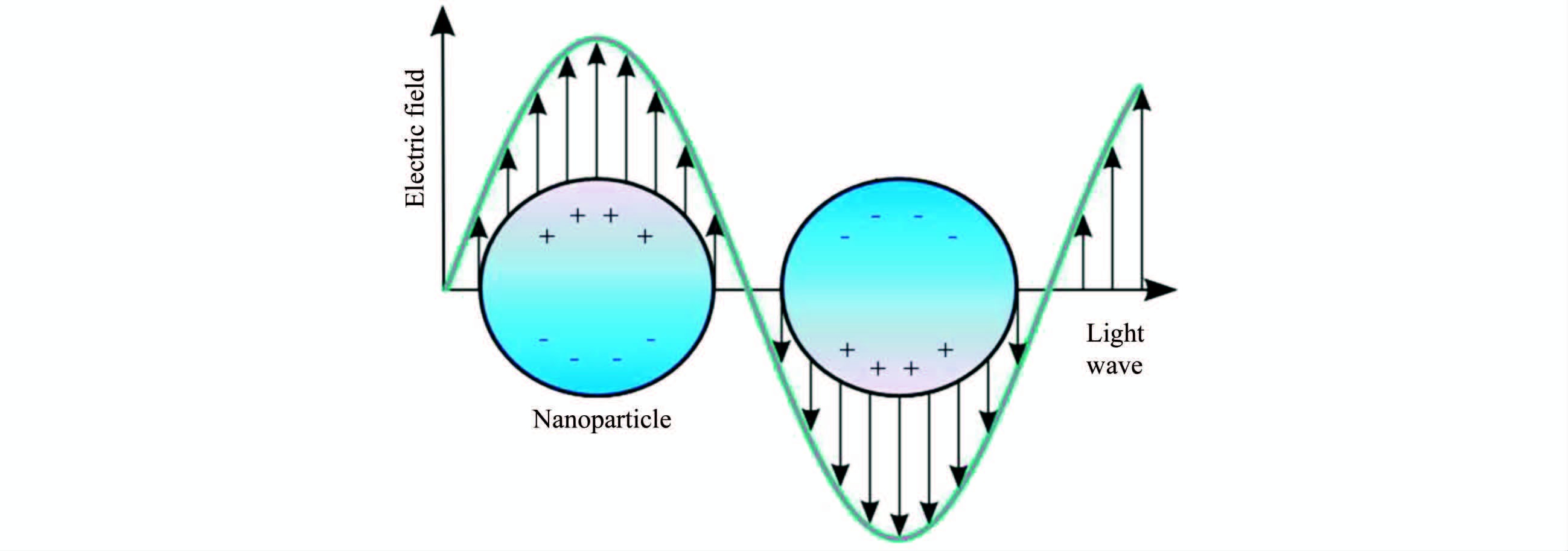
|
图 4 纳米颗粒表面出现局域等离子共振的图示[16] Fig.4 Schematic diagram illustrating the localized surface plasmon on a nanoparticle surface[16] |
这种共振(振荡)可对纳米颗粒表面的吸收、散射,以及电磁场的增大产生很大的影响,而且这种吸收和散射的增长已经在局域表面等离子共振(LSPR)的生物传感上得到实际的应用。电磁场的增强也已被证明,它对用于生物检测的表面增强拉曼光谱(SERS)是十分重要的。有关SERS方面的讨论可参看有关文献[17],这里不拟多述。
为了解在出现共振时可引起吸收和散射增长的因子,人们想到利用Mie的理论。Mie 理论是于球形边界条件下对Maxwell 公式的一个分析解,它可用于描述给定纳米颗粒的消光光谱。为了更准确地计算在不同波长下的介电常数以及将这一理论扩展到更为复杂的形状,就要采用修饰的长波长近似(MLWA)的Mie理论[18]:
| ${{C}_{ext}}=\frac{24{{\pi }^{2}}{{R}^{3}}\varepsilon _{m}^{3/2}N}{\lambda ln\left( 10 \right)}\frac{{{\varepsilon }_{i}}}{{{({{\varepsilon }_{r}}+\chi {{\varepsilon }_{m}})}^{2}}+\varepsilon _{i}^{2}}$ | (1) |
式(1)中的R是颗粒的半径,λ为入射光的波长,εm是周围介质的介电常数,ε=εr +iεi 为大块金属的复合介电常数,N为电子密度,而χ则可归之于与颗粒形状相关的“形状因子”,它是将颗粒模拟为一椭圆形的、与a/b成比例的数值,其中a和b分别为椭圆的短轴与长轴的长度。如式(1)所示,许多因素(例如纳米颗粒的形状、入射光的波长、材料的类型以及周围介质等)都对吸收和散射过程有所影响。但实际上,其周围介质的介电常数对等离子体纳米颗粒的吸收光谱具有最大的影响,并且它已经成为在LSPR生物传感领域中所进行的许多工作的重要基础。当一个生物学的分析物种被绑定于纳米颗粒表面时,就可引起纳米颗粒表面折射系数的改变,从而使LSPR的峰值吸收发生位移。LSPR峰值频率的位移也可因纳米颗粒的组成及形状而有所变动。如:银为所有等离子材料中具有最大负实数的介电常数,它在生物分子被绑定时有最为敏感的局域折射率的变化。此外,有着不对称形状的纳米颗粒,与球形的颗粒相比,也会在生物分子被绑定时产生更为敏感的变化。有关分析物被绑定后,与LSPR频率或波长间的位移Δλ存在着下列关系:
| $\Delta \lambda =m(\Delta n)[1-exp(\frac{-2d}{{{l}_{d}}})]$ | (2) |
式(2)中的m为折射指数的敏感度,Δn为由吸附物所引起的折射率变化,d为有效吸附层的厚度,而ld 则为近似于指数衰变的电磁场衰变长度。于是,两个决定LSPR位移大小的关键性变数为:吸附物相对于溶液的折射率之差(Δn),以及被绑定到纳米颗粒表面分析物尺寸的大小(d)。至于式中折射率的敏感度(m),可通过以LSPR频率对金属电子结构Drude模型所预示的不同折射率(在一相对小的折射率变化范围内)作图所得线性关系的斜率来确定。需要注意的是,电磁场的衰变长度ld对LSPR的位移也有所影响,并且这一衰变对纳米颗粒的形状十分敏感。对于许多纳米颗粒(直径50~100 nm)来说,它们电磁场的衰变长度近似于蛋白质分子的长度(5~10 nm),因此这些贵金属纳米颗粒有着独特的灵敏度来感知生物分子被绑定于它们的表面。
由于在生物分子的检测中,折射率的灵敏度对于传感器是十分关键的因素,因此许多研究者都试图制得能显示出有高灵敏折射率变化的纳米颗粒基质。有趣的是,近年来的一些模拟工作强烈地建议:当材料的LSPR频率从蓝向红的波段位移时,其对折射率的灵敏度也会以线性的形式随之而增大。而LSPR频率向长波方向位移,则可通过建立一个较大的不对称结构而实现。此外,当两个等离子结构相互靠近或接触时,它们的电磁场间也可发生偶合,从而产生出一个趋向于长波方向的更大位移。因此,如果传感膜片附近存在等离子活性物种,常会对膜片的LSPR频率有很大的影响,甚至会超过由折射率的变化所引起的结果。因此在改进和提高生物学传感器灵敏度的大量研究中,采用等离子偶合的方法来使检测信号放大,就成为一种重要的手段。有关这种放大效应,将在下文中作更详细的讨论。
为了能在生物学和细胞学的图像中达到有效的反差,对纳米材料形状作合理的选择是一条很重要的途径。El-Sayed小组利用Mie理论和离散偶极近似(discrete dipole approximation)的方法[15],对于3类常用的纳米颗粒(金纳米球,氧化硅/金纳米核-壳结构球,金纳米棒等),通过计算它们的吸收和散射效率以及光学共振的波长得到了一批十分有趣的结果。他们发现对于金纳米球,当其尺寸由20 nm向80 nm增大时,消光以及散射在总消光中的相对贡献都有很快的增长。 而且,通常所用的金纳米球(尺寸~40 nm)显示出其吸收截面高于通用的吸收染料约5个数量级;而80 nm纳米球的光散射,发射量级也高于强荧光染料所发射的光约5个数量级。但是这些金纳米球的等离子共振波长峰值的变动则在520~550 nm之间,这对于实际应用而言应是十分有限的。氧化硅/金纳米核-壳材料也有与纳米金球可相互比较的、甚至超过它的光学截面。此外,它们还可在近红外区域内出现很好的光学共振,而共振波长则可通过增大纳米球的总尺寸或增大核/壳的半径比而增大。纳米核-壳材料的总消光值与它们的总尺寸间存在线性关系,但并不与核-壳的半径比相关。而在消光中散射的相对贡献,则可通过增大纳米壳的尺寸或减小核/壳的半径比而增大。对纳米金棒的计算显示,当有效尺寸较小时,它具有可与纳米球和纳米核-壳体相比较的光学截面。由于纳米棒易于制备,且能合理地对产物的长/宽比加以控制,因而受到较多的关注。有趣的是纳米棒可显示出有两个等离子的共振吸收,一个是电子的横向振荡引起的,对于金而言,它位于520 nm处,另一个则为径向的等离子共振,处于较长的波长处(于近红外区)。在图 5中列出了具有不同长/宽比的纳米棒状材料的共振吸收结果。图中可清楚地看出:对纳米棒材料的有效尺寸或其长/宽比(aspect ratio)进行调整时,它们的等离子共振吸收的峰值波长也可以随之发生线性变化。
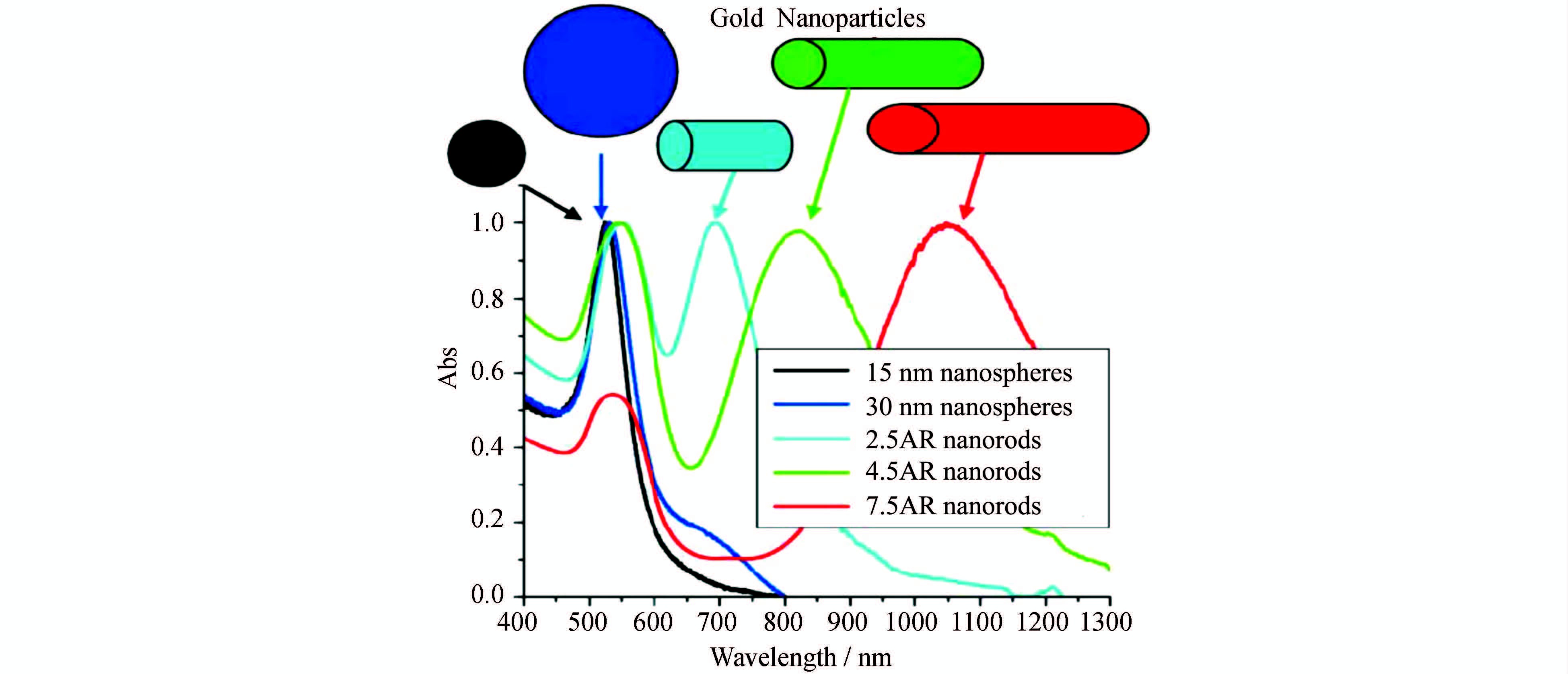
|
图 5 不同形状与尺寸大小的金纳米材料的等离子共振吸收谱[15] Fig.5 The absorption spectra of gold nanoparticles with various sizes and shapes[15] |
为了在实际应用中对不同形状纳米颗粒的有效性进行比较,研究者们还对这些材料的光学截面进行了归一化计算,得到了每微米材料的吸收与散射系数,发现金的纳米棒所显示的每微米的吸收与散射系数要比纳米核-壳和纳米球的系数高约一个数量级。因此认为:具有较高长-宽比和较小有效半径的纳米棒应当是最好的光吸收纳米材料,亦即采用这些尺寸的纳米棒材料,在图像的应用中将得到最高的散射反差。
有关提高SPR传感器灵敏度的方法已经有了多种不同的建议,值得注意的基本策略大致可归纳为两点:(1)在纳米材料的基础上来增强SPR传感基质的灵敏度;(2)以纳米材料强化了的SPR传感器进一步结合其他的手段来达到最佳的SPR传感行为,用以检测痕量的目标检测物。当然,还可利用新发现的如超常光学传输等新现象来探索具有较高灵敏度的产品。
贵金属的纳米颗粒(特别是金纳米颗粒)是最常用的改进PSPR传感行为的材料,这些颗粒可称之为等离子纳米颗粒,它们呈现出强烈的在可见光和近红外光区的吸收,其表面因LSPR的产生所引出的大电场促进了SPR 的灵敏度。这就证明SPR传感基质灵敏度的提高是与这一激发产生的电场紧密相关的,因为越是大的电场存在,就越有大的SPR随周围介质而变得灵敏。LSPR与通用PSPR传感器金属薄膜所产生的表面等离子波的偶合可以有较大的电场增强,从而提高灵敏度。此外,金属纳米颗粒表面与不同分子间的功能化也较易完成,这就允许人们来装配表面的覆盖层和改进目标分子与颗粒表面间的绑定效率,或给与传感膜特定的相互作用等,所有这些都对痕量物质的检测有益,可使器件的检测水平得以提高。下面进一步对有关SPR传感器信号放大问题作更具体的说明:
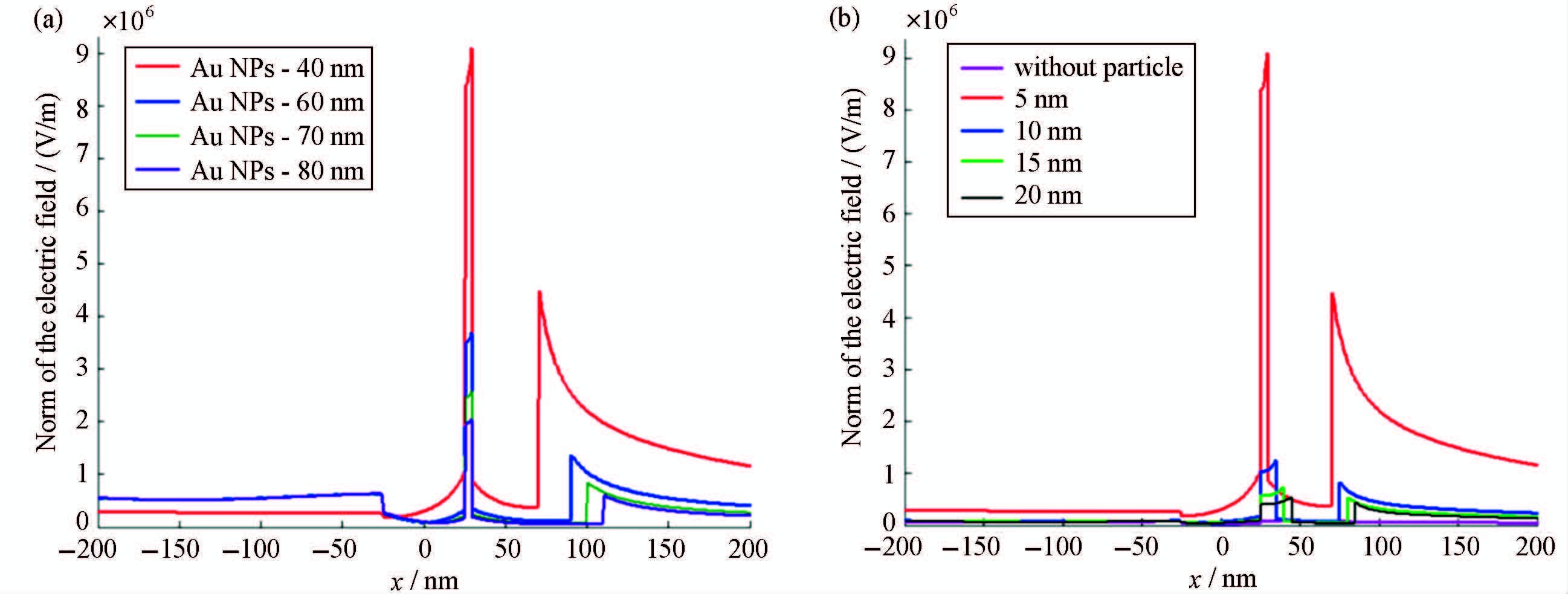
1. 金纳米颗粒-放大的SPR传感器[9, 10, 19]金纳米颗粒通常可用作通用的PSPR传感器的信号放大的标签。如前述的,金纳米颗粒的LSPR共振峰强烈的依赖于它的尺寸大小、形状及周围介质的介电常数,例如金纳米棒的LSPR就可以通过调节它的长/宽比使共振峰的位置从可见光到近红外的波长区间内变动。于是就可通过“正确地”挑选一个能与PSPR等离子共振波长相对应的金纳米颗粒与它结合,以提高场的增强效应,进而提高传感器的灵敏度。新加坡和香港的一些学者曾通过有限元分析的方法来模拟球形金纳米颗粒与传感膜间的偶合,得到了理论与实验结果十分相符的良好结果[3],如图 6所示。
|
图 6 按有限元分析方法模拟共振球与传感膜偶合所得的结果 图(a)为不同直径金纳米球引起电场强度的变化;图(b)为金纳米球与传感膜间距离不同时的电场强度[3] Fig.6 The results were obtained from the Finite element method to simulate the coupling between sensing membrane and nanosphere. (a) shows the changing of the electric field intensty induced by the different diameter of gold nanosphere, and (b) shows the intensity under various distance between sensing membrane and nanosphere[3] |
从图 6的结果可以看出,当金纳米颗粒直径为40 nm时,金颗粒对传感膜电场的增强有着最大的影响。而引入的金纳米颗粒与传感膜间距离最近时,传感膜电场的增强效应最为显著。显然,通过对这些条件的选定,必将对器件灵敏度的提高大有帮助。
2. 超常光学传输(Extraordinary Optical Transmission,EOT)这里还要介绍一种依据新发现的现象而构成的用以提高等离子共振传感灵敏度的方法,即采用所谓的具有超常光学传输现象的结构来设计和构建传感器。这是一种以具有纳米小孔有序排列的金属薄膜为传感器基本部件的传感器件。显然,它与以棱镜对光进行聚焦的BIAcoreTM SPR产品有所不同。 超常光学传输(EOT)是由Ebbesen于1998年发现的一种新现象:当入射光通过有着规则排列和周期性重复的亚波长小孔的金属薄膜时,它可在特定的波长下出现这种超常的光传输增强的现象。按照经典的小孔理论(aperture theory)[20],当以波长为λ的光对具有亚波长尺度的小孔照射时,其透射率T可以下式表示:
| $T=1024/27{{\pi }^{2}}{{(r/\lambda )}^{4}}$ | (3) |
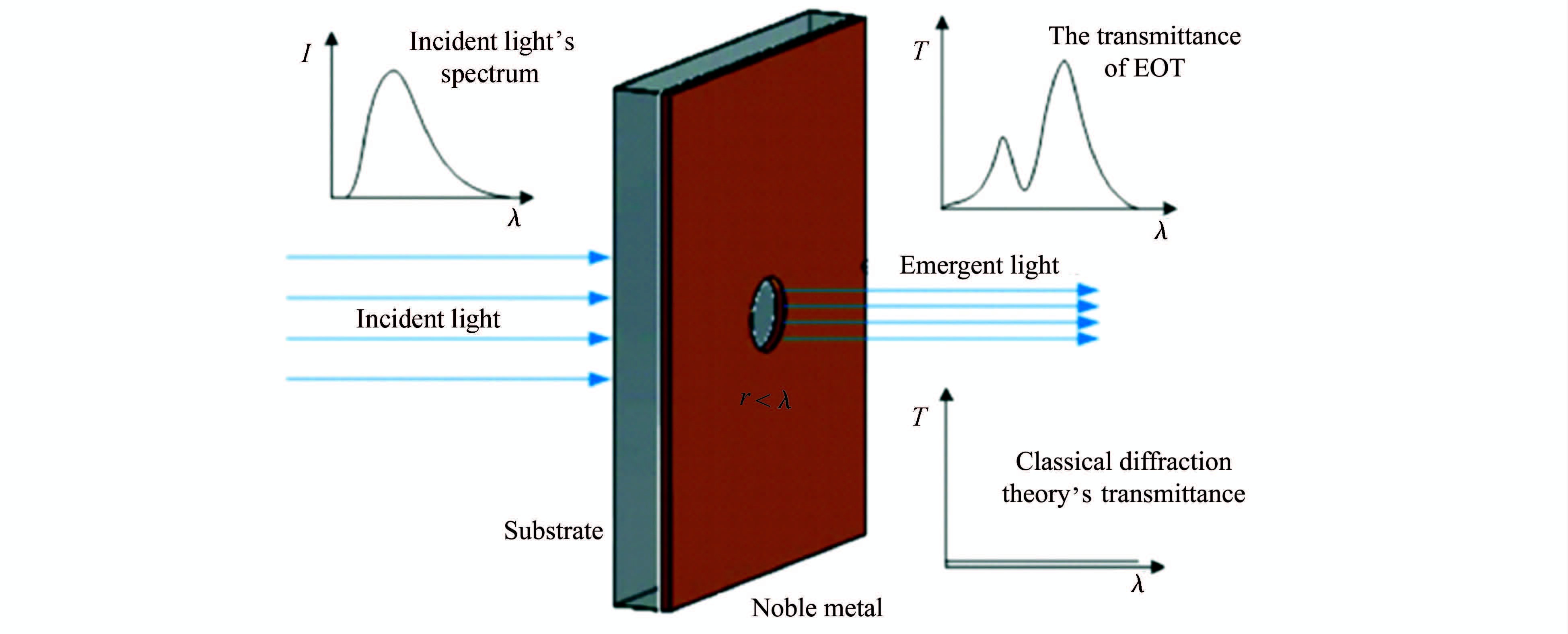
式中的r为小孔半径。可以看出,当入射光通过小孔时,其透过的光强会减小达4个数量级。但Ebbesen[21]对有规则排列小孔的金属薄膜进行光照实验时(孔径仅为照射波长1/10)发现,在透过的光谱中出现了很强的峰值波长,其强度可大于上列公式所预示的结果几个数量级。于是这一现象就被称之为超常的光学传输现象,如图 7所示。
|
图 7 当入射光通过透明基体带有小孔的金属薄膜时,按经典衍射理论和按EOT现象所得透过光的比较[21] Fig.7 The incident light gets through the thin metal membrane with small hole on transparent substrate,the transmitting light according to classical diffracting theory is different with the results from EOT phenomenon[21] |
这一有趣现象的产生,其部分原因可归之于表面等离子共振和结构性的干涉。近年来,不少的工作认为EOT的出现应来自重叠倏逝波的偶合,即当大量的纳米小孔规则而有周期性地排布在金属表面时,它们可将产生的等离子共振合并起来,并将能量通过小孔穿过金属薄膜,因此EOT能使光通过表面时会出现强化的现象,这种效应能对金属薄膜两侧都会有影响。
进一步的研究指出:单独的等离子共振是不能解释这一现象的。对仅有一个小孔的金属薄膜与有着多个小孔、相同体积的薄膜相比较,前者在光照下只有很少量的光出现于另一个面上。甚至还发现,即使采用很薄的金属膜,仍然不能使较多的光穿过。于是有人提出一种看法:入射光与沿着表面的自由电子间发生了强烈的薄层状的等离子激元,即它可形成另一种波形——所谓的准-柱状波(quasi-cylindrical waves,QCW),因此靠近小孔的电子行为与常规处于表面的电子有所不同。总之,这一有趣而重要的现象,目前尚未得到完全的认识,正吸引着人们对它进行广泛的研究。
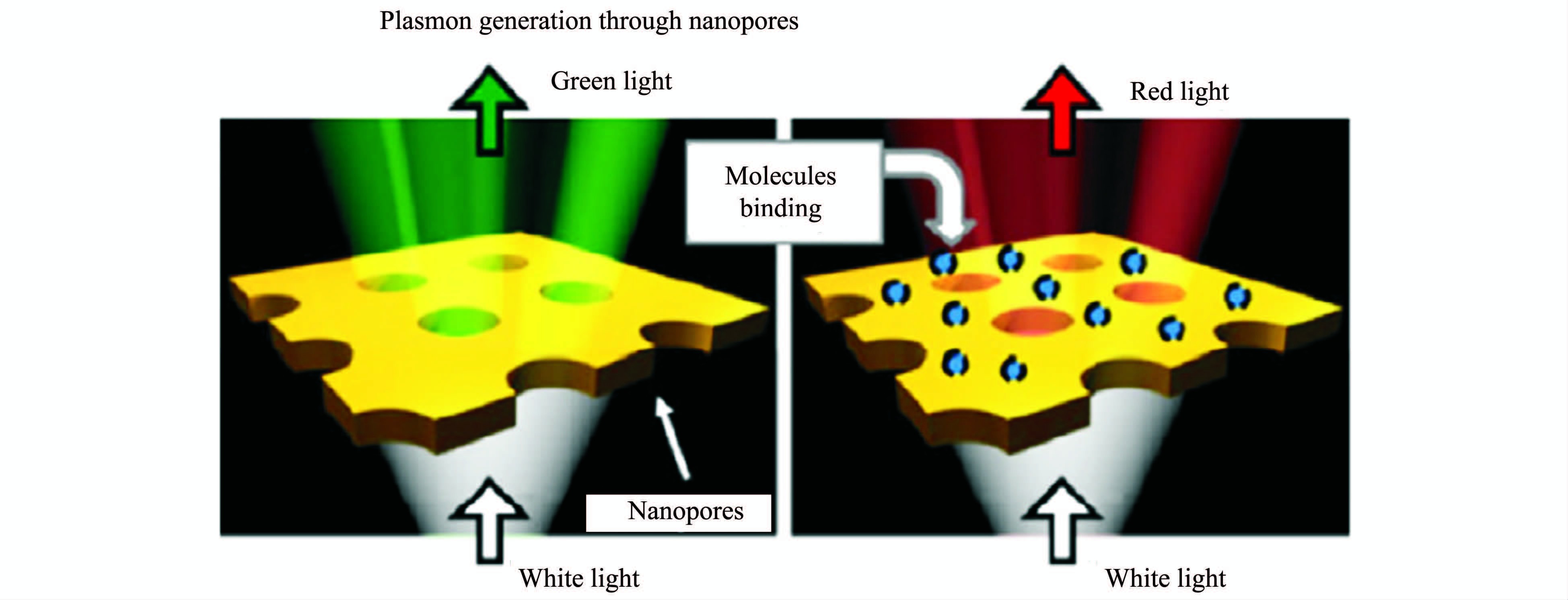
这一现象也已在实际工作中得到应用。当人们将被检测的分子绑定于这些有孔的金属表面时,就可使最优化的光传输波长移动到某另一特定波长之下,这就可使该表面作为一传感器件。由于可在金属膜的表面图像化大量的纳米小孔,因此这一方法的传感能力大大高于由传统SPR仪器所能达到的水平。此外,有人将类脂(Lipid)的双层膜以及含有某些膜蛋白的双层膜铺展在这些纳米小孔之上,由于双层膜可以与小孔的两侧相接近,这就允许绑定到膜蛋白上的类脂分子可以在一种更加天然或接近于天然的环境下来进行SPR的分析,如图 8所示。这一方法已经在α-血红素被绑定于它特殊抗体的例子中得到证实[22, 23]。
|
图 8 具有纳米小孔的金属膜在绑定了检测分子后,由于产生了等离子共振,通过小孔增强的透过光波长从绿向红移动[23] Fig.8 After binding the molecule detected on metal membrane with small hole ,the peak wavelength of surface plasmon resonance of EOT pass through the hole will be shifted to red[23] |
近年来,作为一种无标记、可采用相对小量材料进行检测的等离子共振技术(SPR)有了迅速发展。这是由于它可快速地对两种分子(例如膜蛋白与配体间)作实时绑定与实时动力学研究,并作出定量表征。膜蛋白与配体间的相互作用是与目前一些流行药物的靶向物——膜蛋白体系与药物分子间的绑定作用相关,系统地对这类反应的绑定能力进行测定与研究,可以达到筛选各种化合物能否用作候选潜在药物的重要目的[23]。可以看出这种研究在药物的开发方面十分重要,显然,这也成为SPR技术得以迅速发展的一种重要驱动力。本文对SPR技术近年来的进展及存在的可以进一步改进的空间作了简单的介绍。由于本文所讨论的问题涉及广泛的学科领域,错误在所难免,希读者不吝指正,是以为感。
| [1] | Prasad P N. Introduction to Biophotonics[M]. New York: Wiley-Interscience, 2003 . |
| [2] | Hoa X D, Kirk A G, Tabrizian M. Towards integrated and sensitive surface plasmon resonance biosensors:a review of recent progress[J]. Biosensors and Bioelectronics, 2007, 23 (2) :151–160. DOI:10.1016/j.bios.2007.07.001 |
| [3] | Zeng S W, Baillargeat D, Ho H P, Yong K T. Nanomaterials enhanced surface plasmon resonance for biological and chemical sensing applications[J]. Chemical Society Reviews, 2014, 43 (10) :3426–3452. DOI:10.1039/c3cs60479a |
| [4] | Situ C, Mooney M H, Elliott C T, Buijs J. Advances in surface plasmon resonance biosensor technology towards high-throughput, food-safety analysis[J]. TrAC Trends in Analytical Chemistry, 2010, 29 (11) :1305–1315. DOI:10.1016/j.trac.2010.09.003 |
| [5] | Szunerits S, Maalouli N, Wijaya E, Vilcot J P, Boukherroub R. Recent advances in the development of graphene-based surface plasmon resonance (SPR) interfaces[J]. Analytical and Bioanalytical Chemistry, 2013, 405 (5) :1435–1443. DOI:10.1007/s00216-012-6624-0 |
| [6] | Stewart M E, Anderton C R, Thompson L B, Maria J, Gray S K, Rogers J A, Nuzzo R G. Nanostructured plasmonic sensors[J]. Chemical Reviews, 2008, 108 (2) :494–521. DOI:10.1021/cr068126n |
| [7] | Zeng S W, Yu X, Law W C, Zhang Y, Hu R, Dinh X Q, Ho H P, Yong K T. Size dependence of Au NP-enhanced surface plasmon resonance based on differential phase measurement[J]. Sensors and Actuators B:Chemical, 2013, 176 :1128–1133. DOI:10.1016/j.snb.2012.09.073 |
| [8] | Zeng S W, Yong K T, Roy I, Dinh X Q, Yu X, Luan F. A review on functionalized gold nanoparticles for biosensing applications[J]. Plasmonics, 2011, 6 (3) :491–506. DOI:10.1007/s11468-011-9228-1 |
| [9] | Hong X, Hall E A H. Contribution of gold nanoparticles to the signal amplification in surface plasmon resonance[J]. Analyst, 2012, 137 (20) :4712–4719. DOI:10.1039/c2an35742a |
| [10] | Saha K, Agasti S S, Kim C, Li X N, Rotello V M. Gold nanoparticles in chemical and biological sensing[J]. Chemical Reviews, 2012, 112 (5) :2739–2779. DOI:10.1021/cr2001178 |
| [11] | Malinsky M D, Kelly K L, Schatz G C, Van Duyne R P. Chain length dependence and sensing capabilities of the localized surface plasmon resonance of silver nanoparticles chemically modified with alkanethiol self-assembled monolayers[J]. Journal of the American Chemical Society, 2001, 123 (7) :1471–1482. DOI:10.1021/ja003312a |
| [12] | Haes A J, Zou S, Schatz G C, Van Duyne R P. A nanoscale optical biosensor:the long range distance dependence of the localized surface plasmon resonance of noble metal nanoparticles[J]. Journal of Physical Chemistry B, 2004, 108 (1) :109–116. DOI:10.1021/jp0361327 |
| [13] | Haes A J, Zou S, Schatz G C, Van Duyne R P. Nanoscale optical biosensor:short range distance dependence of the localized surface plasmon resonance of noble metal nanoparticles[J]. Journal of Physical Chemistry B, 2004, 108 (22) :6961–6968. DOI:10.1021/jp036261n |
| [14] | Haes A J, Zou S L, Zhao J, Schatz G C, Van Duyne R P. Localized surface plasmon resonance spectroscopy near molecular resonances[J]. Journal of the American Chemical Society, 2006, 128 (33) :10905–10914. DOI:10.1021/ja063575q |
| [15] | Eustis S, El-Sayed M A. Why gold nanoparticles are more precious than pretty gold:noble metal surface plasmon resonance and its enhancement of the radiative and nonradiative properties of nanocrystals of different shapes[J]. Chemical Society Reviews, 2006, 35 (3) :209–217. DOI:10.1039/B514191E |
| [16] | Unser S, Bruzas I, He J, Sagle L. Localized surface plasmon resonance biosensing:current challenges and approaches[J]. Sensors, 2015, 15 (7) :15684–15716. DOI:10.3390/s150715684 |
| [17] | Vo-Dinh T, Wang H N, Scaffidi J. Plasmonic nanoprobes for SERS biosensing and bioimaging[J]. Journal of Biophotonics, 2010, 3 (1-2) :89–102. |
| [18] | Yang W H, Schatz G C, Van-Duyne R P. Discrete dipole approximation for calculating extinction and Raman intensities for small particles with arbitrary shapes[J]. The Journal of Chemical Physics, 1995, 103 (3) :869–875. DOI:10.1063/1.469787 |
| [19] | Cobley C M, Chen J Y, Cho E C, Wang L V, Xia Y N. Gold nanostructures:a class of multifunctional materials for biomedical applications[J]. Chemical Society Reviews, 2011, 40 (1) :44–56. DOI:10.1039/B821763G |
| [20] | Bethe H A. Theory of diffraction by small holes[J]. Physical Review, 1944, 66 (7-8) :163–182. DOI:10.1103/PhysRev.66.163 |
| [21] | Ebbesen T W, Lezec H J, Ghaemi H F, Thio T, Wolff P A. Extraordinary optical transmission through sub-wavelength hole arrays[J]. Nature, 1998, 391 :667–669. DOI:10.1038/35570 |
| [22] | Im H, Wittenberg N J, Lesuffleur A, Lindquist N C, Oh S H. Membrane protein biosensing with plasmonic nanopore arrays and pore-spanning lipid membranes[J]. Chemical Science, 2010, 1 (6) :688–696. DOI:10.1039/c0sc00365d |
| [23] | Patching S G. Surface plasmon resonance spectroscopy for characterisation of membrane protein-ligand interactions and its potential for drug discovery[J]. Biochimica et Biophysica Acta, 2014, 1838 :43–55. DOI:10.1016/j.bbamem.2013.04.028 |




