2. 中国科学院 理化技术研究所, 北京 100190;
3. 山西农业大学, 山西 太谷 030801
2. Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Beijing 100190, P. R. China;
3. Shanxi Agricultural University, Taigu 030801, Shanxi, P. R. China
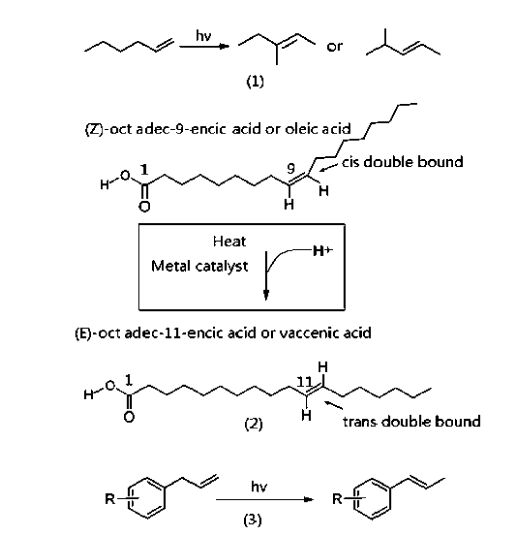
烯烃作为一种有机化合物的骨架结构,广泛存在于石油化工、精细化工和生物制药等领域。因其含有C=C官能团,故可通过对该官能团进行修饰生成新的有机化合物。但天然存在的烯烃种类少,为满足不同类型反应对烯烃的需求,各种烯烃合成方法应运而生。如消除、还原、偶联、缩合、加成和异构化及重排反应等。其中异构化是一种可不改变有机化合物骨架,而通过C=C位置迁移或顺反异构转换创造新烯烃的原子经济性反应。烯烃异构化是指C=C沿碳链发生位置迁移,或其所连官能团发生顺式/反式构型变换,如图 1所示。

|
图 1 烯烃C=C异构 R,R′= —H,烷基,—OH,烯基,苯基,环烷基,环烯基,—CHO,—COOH和—COOR等 Fig.1 Olefins double bond isomerization |
通过催化方式将烯烃中C=C异构生成传统方法难以合成的位置异构体和几何异构体[1],其不仅在有机合成领域中具有重要的科学意义,在石油化工、药物合成、精细化工和生物工程等领域中也具有重要的研究价值和应用前景。
实现烯烃C=C异构化的途径大体包括5类:酸催化、碱催化、分子筛催化、过渡金属化合物催化、光催化。5种催化方式的反应机理和特点各异,本文列表分述5种类型催化方式在烯烃碳碳双键异构化中各自的特点,如表 1所示。
| 表 1 烯烃异构化反应的催化体系 Table 1 Catalytic systems for olefin isomerization |
酸催化的烯烃异构是指烯烃在酸性催化剂的参与下,碳碳双键与催化剂离解的质子相互作用,生成具有活性的碳正离子中间体(Carbonium ions),诱导邻位质子发生离解,生成新的异位碳碳双键,得到具有一定顺反(Z/E)比例的热力学更稳定的混合烯烃。
自20世纪60年代起,Asinger等[2]相继采用硫酸、高氯酸等中强酸均相催化α-十一烯烃,通过控制不同溶剂、酸浓度和反应温度等参数异构生成混合内烯烃。其中高氯酸/酸酐作催化体系时,在100 ℃下,可高效率地促进异构化反应,副反应(主要指聚合反应)少;而以BF3、HBF4或AlCl3等催化α-十一烯烃,则会在较短反应时间内发生大量烯烃聚合反应[2]。在上述均相反应中,催化剂无法回收利用,且强酸易腐蚀设备,因此研究人员又相继采用固体酸, 如AlCl3、Al2O3、SiO2、WO3、介孔状TiO2、Nb2O5和Ta2O5等作为异相催化剂催化烯烃异构[3-6]。其中AlCl3催化异构反应,副产物较多;γ-Al2O3作为两性氧化物,酸性位点可作为催化中心催化烯烃分子,促进碳碳双键迁移和顺反异构,非酸性位点则可促进其它反应如醇脱水等。SiO2-Al2O3-MgO可促进1-丁烯异构生成顺式2-丁烯和反式2-丁烯。此类异相催化剂因较易从反应体系中分离处理,正逐步取代均相催化在烯烃异构反应中的应用。
阳离子交换酸性树脂是一种固体催化剂,其作用机理与硫酸等均相催化相同,树脂固载的酸性催化剂与硅胶、Al2O3或沸石作载体的活性部位相近,近似假均相体系,因此被用以催化气相短链烯烃(C4~C7)异构,如α-丁烯异构生成一定顺/反组成的2-丁烯,产率可达90%[7-14]。该种类型催化剂的特点是:根据不同应用目的可制成不同形状、结构和负载容量的树脂催化剂。活性基团通常位于内孔表面,易于接触烯烃反应物,故催化反应速度快,产率高;树脂具有颗粒和多孔状,反应完成后可通过过滤方法进行分离,而非像传统酸催化剂使用后那样需进行中和、洗涤、干燥和蒸馏等后处理程序,催化剂可重复利用且可避免废液对环境的污染。
2 碱催化双键异构是在碱的催化作用下,通过形成烯丙基阴离子,然后脱氢而实现的。在碱作用下烯烃异构化的顺/反比例很大,这是因为烯烃失去质子后所生成的烯丙基中间体,顺式要比反式稳定得多。
目前, 已初步工业化应用的烯烃异构化催化剂主要为强碱固体催化剂,如Na/K-Al2O3或MgO。在反应温度为80~140 ℃,压力为0.34~1.72 MPa时,将α-C33H66异构生成11-C33H66,该催化剂已用于一种SHOP工艺,主要用于制备表面活性剂和洗涤剂所需化工中间体的C10~C18烯烃[25]。该催化工艺路线生产的内烯烃不适于共聚单体,而且工艺路线长,能耗较大,只有大规模生产才可充分回收利用能量,发挥工艺优势。某些强碱,如KOH可单独在DMSO或醇盐体系中,对烯烃化合物-烯丙基苯的取代基丙烯基C=C位置异构起到催化作用,生成香料和食品行业用化工中间体,但目前该体系实验反应时间长、转换率低,存在废液排放和产物分离难等弊端,仍处于实验阶段[27]。
3 分子筛分子筛催化剂可根据其自身携带酸位或碱位的多寡,归为酸催化或者碱催化,因其独特的结构和工业应用前景,本文将其单独列出进行详述。根据结构和组成不同,分子筛可分为沸石分子筛和非沸石分子筛。沸石分子筛具有均匀独特的孔道结构和可调变酸性,包括X-、Y-、ZSM-5和β-型等[36, 37];非沸石分子筛包括金属骨架化合物MOF、SAPO等[30, 35]。Gajda等[32-34]于90年代相继开发了一系列非沸石结构分子筛(NZMS),可在分子水平上控制合成分子筛的组成、孔结构和活性成分分布等,对α-丁烯、α-戊烯等短链烯烃异构进行催化,产物叔碳烯烃可用于制取重整汽油所需的高辛烷值醚类化合物。
4 过渡金属催化剂过渡金属催化剂分贵金属和普通金属。其中贵金属为ⅤB族、ⅥB族、ⅦB族和Ⅷ族,包含的部分金属及其络合物,如Pd、Ru、Rh、Ir和Os等[27, 38, 41-47],可催化α-直链烯烃进行异构化,但该类催化剂价格昂贵,且无法回收再利用,难以工业化应用。而廉价金属,如Fe、Cu、Zn和Co等[27, 39, 40, 48, 49],价格低廉,且可有效促进α-直链烯烃C=C位置发生迁移生成内烯烃。如CoCl2与格氏试剂在50 ℃下将α-十四烯全部异构生成(E)-2-, (Z)-2-和3-十四烯等[27]。Fe和Co络合物可将丙烯基苯侧链上的烯丙基C=C位置内移,异构生成各种烯丙基苯中间体,可用作香料、抗生素、杀虫剂、抗利什曼原虫药、抗真菌、抑藻剂、消炎药和抗氧化剂等的中间体。
5 光催化光催化技术是近几年国际上最活跃的研究领域之一,主要研究光解水制氢、太阳能光伏电池和二氧化碳能源化等。1983年,芳香卤代烃羰基化的光合成,开启了光催化在有机合成领域中的应用,其中烯烃的光异构反应尤其引人注目。相对于热化学,光催化有机反应具有如下特点:条件温和、环境安全、合成时基团不需保护,常规合成中插入光反应可极大缩短路线。1984年,Cirjak等[50]以金属原子簇合物(C5R5)aFebMc(CO)dLe作为光催化剂对烯烃进行异构化反应,催化剂吸收波长范围覆盖220 nm以上,但产率不高。除催化烯烃C=C位置迁移异构,某些光催化剂如Pd@TiO2可将烯丙基芳烃侧链的烯丙基上C=C位置进行内移形成异构体[53],[HFeM(CO)8L-]或Fe(CO)5可作为光催化剂,在室温光照条件下在四氢呋喃THF溶液中催化1-烯丙基苯,异构生成2-烯丙基苯[52]。条件温和,反应产率高于98%,且产物中E/Z=10:1,具有良好的选择性。
笔者近几年利用系列固体酸及其负载型分子筛作为光催化剂[51]开展研究工作,发现在可见光照下,少量催化剂对常温常压下的直链α-烯烃(C5~C20)C=C异构生成内烯烃表现出强烈催化活性,1 h内转化率均可达80%以上,选择性高。该反应进行E/Z选择性合成时,仅生成一种异构体(E体或Z体),而非E/Z混合体,可避免繁琐复杂的E/Z分离过程,这点很重要,尤其当合成某些含有烯烃结构的药物时,无论临床药物还是中间体合成均期望获得高纯度的单个异构体。在紫外线照射下,该类型催化剂对油酸(CH3(CH2)7CHCH(CH2)7COOH, 顺式)进行双键异构反应,优先生成3-trans-、6-trans-和11-trans-十八烯酸等,1 h内转化率达80%以上。该催化体系亦可在紫外光照射,常温常压下催化苯丙烯系列化合物,进行碳碳双键异构反应,选择性制取某种位置异构体,广泛用于生产在医药、生物和材料科学领域中高附加值的化工产品,具有重要的应用价值。具体如图 2所示。该研究开发的多功能催化剂,结合光催化、酸催化、分子筛催化和过渡金属催化4种催化方式,协同促进烯烃及其衍生物的双键转移。目前研究存在的主要问题为:催化剂吸收波长范围狭窄,主要在紫外区和近紫外区,太阳能利用率低;光生载流子复合率高,导致量子效率较低。因此,需对现有催化剂的结构和组成进行改性,如催化剂的晶相结构与缺陷的控制、调节能带位置、表面光敏化等。
|
图 2 烯烃异构化反应(1) 直链烯烃异构;(2) 油酸异构;(3) 苯丙烯系列异构 Fig.2 Carbon-carbon double bond isomerization of straight chain alkenes (1), oleic acid (2) and ally benzene (3) |
笔者认为,光催化烯烃异构反应需从以下几方面取得突破:(1) 进一步阐明光催化的反应历程,特别是光生载流子分离、传输及界面转移的过程,从理论上明确提升催化剂活性所具备的条件;(2) 从诸如纳米材料学、半导体物理和有机合成等学科汲取经验和思路,制备高效能和高活性的新型光催化材料;(3) 完善上述四元催化体系,进一步提升光催化烯烃异构反应的效率。
6 结论与展望综上,本文就5种烯烃双键异构催化方式进行了详述, 认为:(1) 酸催化体系中均相催化已逐步被多相催化替代,经济型固体酸及离子交换树脂在烯烃双键异构的研究与开发中占有重要地位;(2) 碱催化体系是目前已实现工业化的烯烃异构方式,相对而言是目前较为通用的催化方式,但其工艺过程仍存在如能效低等弊端,有待深入改进;(3) 分子筛催化体系中,非沸石分子筛主要用以催化短链烯烃异构,而沸石分子筛则催化碳数为C4~C20的α-烯烃;(4) 过渡金属催化体系中,贵金属类催化剂在烯烃异构反应中效果显著,产率和转化率较高,但其价格昂贵,不宜规模化使用,而廉价金属催化活性有限,催化效果总体不佳;(5) 利用光催化手段研究烯烃异构,是光催化和有机化学领域中的一个研究热点,且正逐步从实验室走向工业化。随着纳米材料学、半导体物理和光化学等学科的飞速发展,相信通过不懈努力,光催化在烯烃异构反应中的研究与开发终将取得决定性突破。
| [1] | Higman C S, Lanterna A E, Marin L, Scaiano J C, Fogg D E. Catalyst decomposition during olefin metathesis yields isomerization-active ruthenium nanoparticles[J]. Chemical Catalyst and Chemistry, 2016, 8(15): 2446–2449. |
| [2] | Asinger F, Fell B, Collin G. Über die doppelbindungsisomerisierung bei höhermolek olefinen, Ⅳ. Über den bindungsisomerisierenden einfluẞ verschiedener verbindungen auf n-undecene[J]. Chemische Berichte, 1963, 96(3): 716–735. DOI:10.1002/(ISSN)1099-0682 |
| [3] | Ahn J H, Ihm S K, Park K S. The effects of the local concentration and distribution of sulfonic acid groups on 1-butene isomerization catalyzed by macroporous ion-exchange resin catalysts[J]. Journal of Catalysis, 1988, 113(2): 434–443. DOI:10.1016/0021-9517(88)90269-2 |
| [4] | Petrus L, Roo R W D, Stamhuis E J, Joosten G E H. Kinetics and equilibria of the hydration of propene over a strong acid ion exchange resin as catalyst[J]. Chemical Engineering Science, 1984, 39(3): 433–446. DOI:10.1016/0009-2509(84)80041-X |
| [5] | Slomkiewicz P M. Isomerization of C-4 alkenes catalysed by macroporous ion exchange resin[J]. Reactive & Functional Polymers, 1997, 33(2): 299–304. |
| [6] | Gee J C, Williams S T. Dimerization of linear olefins on Amberlyst® 15:Effects of chain length and double-bond position[J]. Journal of Catalysis, 2013, 303: 1–8. DOI:10.1016/j.jcat.2013.03.017 |
| [7] | Uematsu T, Tsukada K, Fujishima M, Hashimoto H. The isomerization of 1-butene over cation-exchanged acidic resin[J]. Chemischer Informationsdienst, 1974, 5(23): 369–375. |
| [8] | Gee J C, Prampin D S. A kinetic and mechanistic study of the double bond and skeletal isomerization of 1-tetradecene on SAPO-11[J]. Applied Catalysis A General, 2009, 360(1): 71–80. DOI:10.1016/j.apcata.2009.03.007 |
| [9] | Harmer M A, Sun Q. Solid acid catalysis using ion-exchange resins[J]. Applied Catalysis A General, 2001, 221(1-2): 45–62. DOI:10.1016/S0926-860X(01)00794-3 |
| [10] | Sun Q, Harmer M A, Farneth W E. But-1-ene isomerization over Nafion(R) resin/silicacomposite catalyst[J]. Chemical Communications, 1996, 10(10): 1201–1202. |
| [11] | Slomkiewicz P M. Isomerization of C-4 alkenes catalysed by macroporous ion exchange resin[J]. Reactive & Functional Polymers, 1997, 33(2): 299–304. |
| [12] | Ghosh R, Bandyopadhyay A R, Jasra R. Mechanistic study of the oligomerization of olefins[J]. Industrial & Engineering Chemistry Research, 2014, 53(18): 47–55. |
| [13] | Onopchenko A, Cupples B L, Kresge A N. Boron fluoride-catalyzed oligomerization of alkenes:structures, mechanisms, and properties[J]. Industrial & Engineering Chemistry Product Research & Development, 1983, 22(2): 182–191. |
| [14] | Höchtl M, Jentys A, Vinek H. Isomerization of 1-pentene over SAPO, CoAPO (AEL, AFI) molecular sieves and HZSM-5[J]. Applied Catalysis A General, 2001, 207(1-2): 397–405. DOI:10.1016/S0926-860X(00)00682-7 |
| [15] | Bruno J E, Dooley K M. Double-bond isomerization of hexadecenes with solid acid catalysts[J]. Applied Catalysis A General, 2015, 497: 176–183. DOI:10.1016/j.apcata.2015.03.009 |
| [16] | Modhera B, Chakraborty M, Parikh P A. 1-Hexene isomerization over nano-crystalline zeolite beta:effects of metal and carrier gases on catalytic performance[J]. Catalysis Letters, 2009, 132(1): 168–173. |
| [17] | Shi G, Shen J. Skeletal isomerization of 1-hexene over sulfided Co/Co-MCM-41 catalysts[J]. Energy & Fuels, 2009, 23(1): 320–326. |
| [18] | Rao Y, Kang J, Antonelli D. 1-Hexene isomerization over sulfated mesoporous Ta oxide:the effects of active site and confinement[J]. Journal of the American Chemical Society, 2008, 130(2): 394–395. DOI:10.1021/ja076584n |
| [19] | Rao Y, Kang J, Trudeau M. Investigation of the catalytic activities of sulfated mesoporous Ti, Nb, and Ta oxides in 1-hexene isomerization[J]. Journal of Catalysis, 2009, 266(1): 1–8. DOI:10.1016/j.jcat.2009.05.014 |
| [20] | Ozaki A, Tsuchija S. The isomerization of n-butenes over a deuterated ion exchange resin[J]. Journal of Catalysis, 1966, 5(3): 537–539. DOI:10.1016/S0021-9517(66)80073-8 |
| [21] | Kalló D, Preszler I. n-Butene isomerization on acidic ion-exchange resin[J]. Journal of Catalysis, 1968, 12(1): 1–4. DOI:10.1016/0021-9517(68)90066-3 |
| [22] | Manassen J, Khalif S. Organic polymers:correlation between their structure and catalytic activity in heterogeneous systems:Ⅲ. acid-type catalysis, sulfonated and phosphonated polyphony[J]. Journal of Catalysis, 1967, 7(2): 110–116. DOI:10.1016/0021-9517(67)90048-6 |
| [23] | Manassen J, Klein F S. 822. Reactions of n-butene and butan-2-ol in dilute acid. The elucidation of the mechanism and the intermediate in elimination from secondary alcohols and in the hydration of olefins[J]. Journal of the Chemical Society, 1960, 3(1): 4203–4213. |
| [24] | Takayoshi U. The isomerization of n-butenes over acidic ion-exchange resin[J]. Bull. Chem. Soc. Jpn, 1972, 45: 3329–3333. DOI:10.1246/bcsj.45.3329 |
| [25] | Lutz E F. Shell higher olefins process[J]. Journal of Chemical Education, 1986, 63: 202. DOI:10.1021/ed063p202 |
| [26] | Fritz H E, Atkins K E, O'Connor G L. Corporation (United Carbide Co., USA), production of alkylidenebicycloheptenes[P]. US patent, 3.347.944, 1967. |
| [27] | Hassam M, Taher A, Arnott G E, Green I R, van Otterlo W A L. Isomerization of allylbenzenes[J]. Chemical Reviews, 2015, 115(11): 5462–5569. DOI:10.1021/acs.chemrev.5b00052 |
| [28] | Jr L S G, Mcdonough J M. Selective isomerization of 1-olefins to 2-olefins[P]. US patent, 3697616 A. 1972. |
| [29] | Hu S, Liu D, Li L, Guo Z, Chen Y, Borgna A. Highly selective 1-heptene isomerization over vanadium grafted mesoporous molecular sieve catalysts[J]. Chemical Engineering Journal, 2010, 165(3): 916–923. DOI:10.1016/j.cej.2010.10.001 |
| [30] | Gajda G J. Butene isomerization process[P]. US patent, 5132484 A. 1992. |
| [31] | Gajda G J, Barger P T. Olefin isomerization process[P]. US patent, 5191146A.1993. |
| [32] | Gajda G J, Barger P T. Pentene isomerization and etherification[P]. US patent, 005292984A. 1994. |
| [33] | Gajda G J, Barger P T, Abrevaya H. Olefin isomerization process[P]. US patent, 05336831A. 1994. |
| [34] | Lawson R J, Richmond D M, Gajda G J, BargerP T. Pentene isomerization process[P]. US patent, 5367101 A. 1994. |
| [35] | Gajda G J, Barger P T. Olefin isomerization process[P]. US patent, 005463161A. 1995. |
| [36] | F ttinger K, Kinger G, Vinek H. 1-Pentene isomerization over zeolites studied by in situ, IR spectroscopy[J]. Catalysis Letters, 2003, 85(1): 117–122. |
| [37] | F ttinger K, Kinger G, Vinek H. 1-Pentene isomerization over FER and BEA[J]. Applied Catalysis A General, 2003, 249(2): 205–212. DOI:10.1016/S0926-860X(03)00192-3 |
| [38] | Müller H, Koehl H, Pommer H. (BASF, USA) Production of 2-methyl-2-hepten-6-one[P]. US patent, 3.670.028, 1972. |
| [39] | Peters B C. Olefin isomerization process[P]. US patent, 4587374, 1986. |
| [40] | Casey C P, Cyr C R. Iron carbonyl catalyzed isomerization of 3-ethyl-1-pentene. multiple olefin isomerizations via a π-allyl metal hydride intermediate[J]. Journal of the American Chemical Society, 1973, 95(7): 2248–2253. DOI:10.1021/ja00788a025 |
| [41] | Cerveny L, Krejeikova A, Marhoul A, Ruzicka V. Isomerization of eugenol to isoeugenol[J]. Reaction Kinetics and Catalysis Letters, 1987, 33(2): 471–476. DOI:10.1007/BF02128108 |
| [42] | Clive D L J, Sannigrahi M, Hisaindee S. Synthesis of(±)-puraquinonic acid:an inducer of cell differentiation[J]. The Journal of Organic Chemistry, 2001, 66(3): 954–961. DOI:10.1021/jo001523s |
| [43] | Castonguay A, Brassard P. C-Alkylation of 1, 3-dihydroxyanthraquinones.total syntheses of (±)-averufin and (±)-bipolarin[J]. Canadian Journal of Chemistry, 1977, 55(8): 1324–1332. DOI:10.1139/v77-183 |
| [44] | Shao M B, Liu G Y, Zhao J J, Wang X Y, Wang J H. RuCl3·3H2O mediated olefin isomerizations in ionic liquids:a highly recyclable system for olefin isomerizations[J]. Chemical Research in Chinese Universities, 2012, 28(1): 67–69. |
| [45] | Fanun M, Ayad Z, Mudalal S, Dahoah S, Meltzer D, Schwarze M, Schomacker R, Blum J. Characterization of water/sucrose laurate/n-propanol/allylbenzene microemulsions[J]. Journal of Surfactants and Detergents, 2012, 15(4): 505–512. DOI:10.1007/s11743-012-1344-1 |
| [46] | Cooper A C, Caulton K G. Identification of an elusive catalyst:IrH (η2-C6H4PtBu2) (Cl) (PtBu2Ph) as a precursor for C=C bond migration[J]. Inorganica Chimica Acta, 1996, 251(s 1-2): 41–51. |
| [47] | Baxendale I R, Lee A L, Ley S V. A concise synthesis of carpanone using solid-supported reagents and scavengers[J]. Journal of the American Chemical Society, Perkin Transactions, 2002, 1: 1850–1857. |
| [48] | Reddy M R, Periasamy M. Isomerization of 1-alkenes using the Na2Fe (Co)4/CuCl and Na2Fe (Co)4/BrCH2CH2Br reagent systems[J]. Journal of Organometallic Chemistry, 1995, 491: 263–266. DOI:10.1016/0022-328X(94)05243-5 |
| [49] | Roos L, Orchin M. Allylbenzene isomerization catalysed by deuteriocobalt tetracarbonyl[J]. Journal of the American Chemical Society, 1965, 87(23): 5502–5504. |
| [50] | Cirjak L M, Sutherland L. Process for the photocatalytic isomerization of olefins utilizing a mixed metal cluster[P].US patent, 4504371. 1985. |
| [51] | Xiao T C, Ma W J. Method of double-bond migrate of terminal olefins[P].GB patent, 053532. 2016. |
| [52] | Tooley P A, Arndt L W, Darensbourg M Y. Olefin isomerization catalysis by heterobimetallic hydrides, HFeM(CO)8L-(M=Cr, Mo, W;L=Co, Pr)[J]. Journal of the American Chemical Society, 1985, 107(8): 2422–2427. DOI:10.1021/ja00294a037 |
| [53] | Elhage A, Lanterna A E, Scaiano J C. Tunable photocatalytic activity of palladium-decorated TiO2:non-hydrogen-mediated hydrogenation or isomerization of benzylsubstituted alkenes[J]. American Chemical Society Catalysis, 2017, 7(1): 250–255. |
| [54] | Onishi M, Oishi S, Sakaguchi M, Takaki I, Hiraki K. Chemical reactivities of coordinatively unsaturated hydridotris-(phosphonite)-cobalt(Ⅰ) species photogenerated towards allylic and related-compounds[J]. Bulletin of the Chemical Society of Japan, 1986, 59(12): 3925–3930. DOI:10.1246/bcsj.59.3925 |
| [55] | Onishi M, Hiraki K, Ishida Y, Fukunaga T. Facile electrogeneration of a 17-electron species from an inert hydridophosphonitecobalt(Ⅰ) for catalytic double-bond migration of 3-phenylpropene[J]. Chemistry Letters, 1986, 15(3): 333–336. DOI:10.1246/cl.1986.333 |




