2. 中国科学院 理化技术研究所, 北京 100190;
3. 电子科技大学 光电信息学院, 四川 成都 611731;
4. 北京理工大学 材料学院, 北京 100081
2. Technical Institute of Physics and Chemistry, Chinese Academy of Sciences, Beijing 100190, P. R. China;
3. School of Optoelectronic Information, University of Electronic Science and Technology of China, Chengdu 611731, Sichuan, P. R. China;
4. School of Materials Science and Engineering, Beijing Institute of Technology, Beijing 100081, P. R. China
有机电致发光二极管(OLED)技术由于在智能手机、平板显示器,以及固体发光等领域都表现出巨大的应用潜力,因而在近三十年来得到了持续的发展[1-5]。其中,发光材料的设计作为OLED技术领域的核心科学问题得到了深入的研究和发展。具有高发光效率、不同发光颜色的有机发光材料被不断地研发出来[2-5]。
在OLED中电致激子按照自旋简并态随机排布,因此器件中产生的单重态激子与三重态激子的比例为1:3[6]。传统有机荧光材料发光时,由于三重态激子的辐射跃迁存在自旋禁阻,只能利用器件中的单重态激子实现发光,因此基于此类材料的传统荧光OLED的理论最大内量子效率(IQE)只有25%[7]。磷光发光材料由于借助重金属原子强烈的自旋轨道耦合效应,三重态的辐射跃迁过程可以从禁阻变为部分允许,从而使得单线态和三线态激子均可辐射跃迁发光,实现100%的激子利用效率的上限[8-10],因而在过去的十几年里,一直是OLED技术领域研究的重点。然而,高成本以及潜在的重金属污染限制了磷光OLED的实际应用与推广。
2012年Adachi小组报导了采用热激活延迟荧光(TADF)材料的新型OLED,实现了高达19.3%的外量子效率(EQE)和几乎100%的激子利用率[11],一跃成为了OLED技术领域新的研究热点[12-15]。TADF技术中使用的发光分子具有极小的最低激发单重态(S1)-激发三重态(T1)能级差(ΔEST),可以在室温条件下,利用反系间窜越(RISC)过程使得原本无法被荧光过程利用的三重态激子转化为可高效发光的单重态激子[11]。与磷光有机发光材料一样,TADF材料理论上也可以实现激子的100%利用;并且由于TADF机制不需要使用重金属原子,可以克服磷光材料的缺点,因而被誉为新一代的OLED技术而得到了广泛关注。
设计具有TADF性质的发光分子的关键在于减少分子中最低未占分子轨道(LUMO)和最高占据分子轨道(HOMO)之间的重叠,从而实现极小ΔEST的分子特性[16]。为此,TADF发光分子一般由电子给体(D)片段和电子受体(A)片段通过几乎垂直的二面角键接而成。
这种近似垂直的D-A结构,能够抑制D段和A段之间的共轭,并严格地将HOMO限制在D片段,LUMO限制在A片段。近几年,很多具有极小ΔEST值的TADF分子已被合成出来,并具有优良的发光性能。但是,这些TADF分子的结构仍然局限于氮杂芳香环[17, 18]、苯氰[19]、二苯硫砜[20]和仲胺衍生物[21],并且这些分子的发光大部分都局限于绿光和天蓝光。因此,设计并合成不同体系、不同发光位置的TADF分子对丰富TADF分子种类、实现基于TADF机制的全色OLED器件,具有重大意义。
1, 3-茚二酮在指纹显色、富勒烯制备以及生物成像等领域具有广泛应用,由于其羰基具有较强的吸电子能力和共轭作用,可以有效降低分子的LUMO能级从而使发光位置红移;然而,由于2号位的活泼氢使得其电化学性质不稳定[22],从而限制了其在OLED领域的广泛应用[23-26]。在本文中,我们将1, 3-茚二酮中2号位的活泼氢原子用甲基取代以提高其化学稳定性,通过在羰基的对位连接不同的给电子基团,成功的将1, 3-茚二酮类发光材料应用于OLED的制备中,实现了基于1, 3-茚二酮TADF分子的不同发光位置的OLED器件。其中以二甲基吖啶为电子给体可以得到蓝光TADF分子IDYD,其在器件中的发光峰为470 nm,最大外量子效率(EQE)为2.13%,最大亮度可达1000 cd·m-2。而以吩噁嗪为电子给体可以得到橙光TADF分子IDPXZ,其在器件中的发光峰为560 nm,最大外量子效率(EQE)为1.31%,最大亮度可达3000 cd·m-2。为了抑制分子的非辐射跃迁,提高器件的效率,我们合成了具有两个给电子片段吩噁嗪的TADF分子ID2PXZ。由于空间位阻的原因,ID2PXZ的HOMO/LUMO具有更小的重叠,在器件中的发光位置为550 nm,最大外量子效率(EQE)提升至2.55%。该结果表明:甲基的引入增加了1, 3-茚二酮在电致发光过程中的稳定性,可以被应用于OLED发光材料的设计中;而2, 2-二甲基-1,3-茚二酮作为电子受体,可以实现较小的电子交换能,并且展示出在全色OLED器件中的发展潜力。
1 实验部分 1.1 试剂本文实验测试所用到的化学药品见表 1。此外,用于光谱测试的乙酸乙酯为北京化学试剂有限公司生产的色谱纯,用于电化学测试的溶剂N, N-二甲基甲酰胺(DMF)为色谱纯,用于光谱测试的溶剂2-甲基四氢呋喃用钠干燥后使用,无水四氢呋喃是按照有关文献的方法将分析纯的四氢呋喃进行了除水和提纯处理,方法如下:在烧瓶内加入THF,向其中加入切成小片的金属钠,在氮气保护下回流2 h后,加入二苯甲酮指示剂,溶剂颜色变为深蓝色后蒸馏收集,在氮气保护下取用。
| 表 1 本文中实验及测试用到的化学药品 Table 1 Chemicals utilized in the experiments |
NMR核磁:Bruker-400超导核磁共振仪;四甲基硅烷(TMS)为内标,氘代试剂为北京化学试剂公司产品;质谱:APEXII型FT-ICR和BIFLEXIII型MALDI-TOF质谱仪;紫外可见吸收光谱:Hitachi UV-3010紫外可见光谱仪;荧光光谱和磷光光谱:Hitachi F-4500荧光光谱仪;循环伏安法(CV)氧化电位的测定:上海辰华仪器公司CHI600 a型电化学分析仪。
1.3 实验合成 1.3.1 中间体ID1的合成将50.8 g (0.15 mol) 5-溴邻苯二甲酸二甲酯溶于60 mL丙酸甲酯中,分批多次加入19.2 g(0.4 mol)60%(质量分数)氢化钠,升温至80 ℃并搅拌4 h,得到浅黄色粘稠的糊状物;然后利用常压蒸馏法将此糊状物中的甲醇、乙醇和丙酸甲酯除去,再进行抽滤,用石油醚洗涤滤渣,真空干燥后得40.5 g的浅黄色的固体。
之后将所述浅黄色固体加入至100 mL浓度为3 mol/L的盐酸溶液中,然后升温至90 ℃并搅拌直到生成CO2除去为止,再进行冷却、抽滤,得浅黄色的结晶,用水洗涤上述浅黄色结晶,然后进行柱层析,真空干燥后得30.2 g的无色针状结晶。此无色针状结晶为2-甲基-5-溴-1, 3-茚二酮(ID1),收率为72.5%。
2-甲基-5 -溴-1, 3-茚二酮的核磁表征结果如下:TOF MS EI+:238.01. 1HNMR (400 MHz, Acetone-d6):8.19 (s, 1H), 7.80~7.88(m, 2H), 4.68 (s, 1H), 1.06 (s, 3H)。13CNMR (100 MHz, Acetone-d6):20.5, 46.5, 126.5, 131.0, 132.5, 136.5, 141.5, 144.5, 201.5。Anal. Calcd for C10H7BrO2: C, 50.24; H, 2.95; Br, 33.42; O, 13.38。Found: C, 50.84; H, 2.55; O, 13.79。
1.3.2 中间体ID2的合成向100 mL的烧瓶中依次加入15.5 g(0.05 mol) 2-甲基-4, 5-溴-1, 3-茚二酮、50 mL甲醇和4.08 g(0.06 mol)乙醇钠,在40 ℃条件下搅拌30 min,得第一混合液;向此第一混合液中加入1.5 mL(0.08 mol)碘甲烷,在40 ℃条件下搅拌2 h,得第二混合液;将此第二混合液溶于水中,然后加入20 mL 3 mol/L稀盐酸并搅拌30 min,得第三混合液;将此第三混合液用乙酸乙酯萃取,萃取后的有机相用无水硫酸钠干燥、过滤,然后蒸馏除去有机液相,得粗产品;将所述粗产品进行柱层析,得7.0 g的2, 2-二甲基-5-溴-1, 3-茚二酮(ID2),收率为40.5%。
2, 2-二甲基-5-溴-1, 3-茚二酮的表征结果如下:TOF MS EI+:252.99. 1HNMR (400 MHz, Acetone-d6): 8.18 (s, 1H), 7.80~7.88(m, 2H), 1.06 (s, 6H)。13CNMR (100 MHz, Acetone-d6): 24.5,67.5, 128.0, 131.0, 133.5, 136.5, 140.5, 143.5, 202.0。Anal. Calcd for C11H9BrO2: C, 52.20; H, 3.58; Br, 31.57; O, 12.64。Found: C, 52.45; H, 3.37。
1.3.3 IDYD的合成在氩气保护下,向装有回流冷凝管的100 mL的两口烧瓶加入5-溴-2, 2-二甲基-1, 3-茚二酮252 mg、9, 9-二甲基吖啶680 mg、醋酸钯15 mg、10%的三叔丁基膦的甲苯溶液0.3 mL、叔丁基醇钾1g、甲苯10 mL,混合得第一混合液;将第一混合液加热至90 ℃并回流搅拌48 h,得第二混合液;将此第二混合液冷却至室温后,蒸馏除去有机溶剂,得第三混合液;向此第三混合液中加入大量水和二氯甲烷进行萃取,萃取后的有机相用无水硫酸钠干燥、过滤,然后蒸馏除去有机液相,得粗产品;将此粗产品用石油醚和二氯甲烷通过柱色谱法进行纯化,然后干燥,得5-二甲基吖啶基-2, 2-二甲基-1, 3-茚二酮(IDYD)的黄色粉末。5-二甲基吖啶基-2, 2-二甲基-1, 3-茚二酮的产量为300 mg,收率为80.1%。
5-二甲基吖啶基-2, 2-二甲基-1, 3-茚二酮(IDYD)的表征结果如下:1HNMR (400 MHz, Dichloromethane-d2):8.21 (d, J = 8.4 Hz, 2H), 8.17 (d, J=7.7 Hz, 2H), 8.15~8.08 (m, 1H), 7.55 (d, J = 8.2 Hz, 2H), 7.52~7.41 (m, 2H), 7.40~7.32 (m, 2H), 1.30~1.40(m,12H)。13CNMR (100 MHz, Dichloromethane-d2):20.3, 24.5, 28.7, 65.3, 115.3, 120.5, 123.4, 125.5, 130.1, 130.5, 131.1, 132.6, 135.8, 143.2, 145.5, 202.8。TOF MS EI+:381.21。Anal. Calcd for C25H21NO2: C, 81.72; H, 5.76; N, 3.81; O, 8.71。Found: C, 81.36; H, 5.92; N, 3.83。
1.3.4 IDPXZ的合成在氩气保护下,向装有回流冷凝管的100 mL的两口烧瓶加入5-溴-2, 2-二甲基-1, 3-茚二酮252 mg、吩噁嗪680 mg、醋酸钯15 mg、10%的三叔丁基膦的甲苯溶液0.3 mL、叔丁基醇钾1 g、甲苯10 mL,得第一混合液;将此混合液加热至90 ℃并回流搅拌48 h,得第二混合液;将此第二混合液冷却至室温后,蒸馏除去有机溶剂,得第三混合液;向此第三混合液中加入大量水和二氯甲烷进行萃取,萃取后的有机相用无水硫酸钠干燥、过滤,然后蒸馏除去有机液相,得粗产品;将所述粗产品用石油醚和二氯甲烷通过柱色谱法进行纯化,然后干燥,得5-吩噁嗪基-2, 2-二甲基-1, 3-茚二酮(IDPXZ)的黄色粉末。5-吩噁嗪基-2,2-二甲基-1,3-茚二酮的产量为290 mg,收率为85.1%。
5-吩噁嗪基-2, 2-二甲基-1, 3-茚二酮(IDPXZ)的表征结果如下:1HNMR (400 MHz, Dichloromethane-d2):8.09 (s, 2H), 6.83~6.73 (m, 4H), 6.72~6.64 (m, 2H), 6.04 (dd, J=15.0, 14.1 Hz, 2H), 1.39~1.33 (m, 6H)。13CNMR (100 MHz, Dichloromethane-d2): 24.5, 65.3, 113.3,115.1,120.2,122.5,122.8,128.1,129.4,134.5,135.6,140.0,142.4,145.5,202.5。TOF MS EI+:355.12。Anal. Calcd for C23H17NO3: C, 77.73; H, 4.82; N, 3.94; O, 13.51。Found: C, 77.62; H, 4.62; N, 3.83。
1.3.5 中间体ID3的合成将52.8 g (0.15 mol) 5,6-二溴邻苯二甲酸二甲酯溶于60 mL丙酸甲酯中,分批多次加入19.2 g(0.4 mol)60%(质量分数)氢化钠,升温至80℃并搅拌4 h,得浅黄色粘稠的糊状物;然后利用常压蒸馏法将所述糊状物中的甲醇、乙醇、丙酸甲酯除去,再进行抽滤,用石油醚洗涤滤渣,真空干燥后得41.5 g的浅黄色的固体。
之后将此浅黄色的固体加入到100 mL的浓度为3 mol/L的盐酸溶液中, 然后升温至90 ℃并且搅拌直到生成的CO2除去为止,再进行冷却、抽滤,得浅黄色的结晶,用水洗涤此浅黄色结晶,然后进行柱层析,真空干燥后得30.9 g无色针状结晶。所述无色针状结晶为2-甲基-5, 6-二溴-1, 3-茚二酮(ID3),收率为70.5%。
2-甲基-5, 6 -二溴-1, 3-茚二酮的表征结果如下:TOF MS EI+:317.95。1HNMR (400 MHz, Acetone-d6):8.08 (s, 2H), 4.68 (m, 1H), 1.06 (s, 3H)。13CNMR (100 MHz, Acetone-d6):20.5,46.5,130.5,134.5,140.5,202.5。Anal. Calcd for C10H6Br2O2: C, 37.77; H, 1.90; Br, 50.26; O, 10.06。Found: C, 37.34; H, 1.83。
1.3.6 中间体ID4的合成向100 mL的烧瓶中依次加入15.5 g(0.05 mol) 2-甲基-4, 5, 6-二溴-1, 3-茚二酮、50 mL甲醇和4.08 g(0.06 mol)乙醇钠,在40 ℃条件下搅拌30 min,得第一混合液;向此第一混合液中加入1.5 mL(0.08 mol)碘甲烷,在40 ℃条件下搅拌2 h,得第二混合液;将此第二混合液溶于水中,然后加入20 mL浓度为3 mol/L的稀盐酸并搅拌30 min,得第三混合液;将此第三混合液用乙酸乙酯萃取,萃取后的有机相用无水硫酸钠干燥、过滤,然后蒸馏除去有机液相,得粗产品;将所述粗产品进行柱层析,得7.2 g的2, 2-二甲基-5, 6-二溴-1, 3-茚二酮(ID2),收率为42.5%。
2, 2-二甲基-5, 6-二溴-1, 3-茚二酮的表征结果如下:TOF MS EI+:331.95。1HNMR (400 MHz, Acetone-d6): 8.08 (s, 2H), 1.06 (s, 6H)。13CNMR (100 MHz, Acetone-d6): 24.5,67.5, 130.5, 134.5, 140.5, 202.5。Anal. Calcd for C11H9BrO2: C, 52.20; H, 3.58; Br, 31.57; O, 12.64。Found: C, 52.32; H, 3.70。
1.3.7 ID2PXZ的合成在氩气保护下,向装有回流冷凝管的100 mL的两口烧瓶加入5, 6-二溴-2, 2-二甲基-1, 3-茚二酮350 mg、吩噁嗪1.5 g、醋酸钯30 mg、10%的三叔丁基膦的甲苯溶液0.6 mL、叔丁基醇钾1 g、甲苯15 mL,得第一混合液;将此第一混合液加热至90 ℃并回流搅拌48 min,得第二混合液;将此第二混合液冷却至室温后,蒸馏除去有机溶剂,得第三混合液;向此第三混合液中加入大量水和二氯甲烷进行萃取,萃取后的有机相用无水硫酸钠干燥、过滤,然后蒸馏除去有机液相,得粗产品;将所述粗产品用石油醚和二氯甲烷通过柱色谱法进行纯化,然后干燥,得到5, 6-二(吩噁嗪-10基)-2, 2-二甲基-1, 3-茚二酮(ID2PXZ)的橙色粉末。5, 6-二(吩噁嗪-10基)-2, 2-二甲基-1, 3-茚二酮的产量为300 mg,收率为40.7%。
5, 6-二(吩噁嗪-10基)-2, 2-二甲基-1, 3-茚二酮(ID2PXZ)的表征结果如下:1HNMR (400 MHz, DMSO-d6):8.09~7.92 (m, 2H), 6.83~6.73 (m, 8H),6.72~6.64 (m, 4H),6.04 (dd, J = 15.0, 14.1 Hz, 4H),1.39~1.33 (m, 6H)。13CNMR (100 MHz, Dichloromethane-d2):24.5,65.3,113.5,115.0,120.1,122.1,122.8,134.5,136.5,137.8,139.2,202.8。TOF MS EI+:536.21。Anal. Calcd for C35H24N2O4: C, 78.34; H, 4.51; N, 5.22; O, 11.93。Found: C, 78.55; H, 4.30; N, 5.45。
2 结果与讨论 2.1 化合物IDYD、IDPXZ和ID2PXZ的合成过程化合物IDYD、IDPXZ和ID2PXZ的合成过程如图 1所示:溴代的邻苯二甲酸甲酯在氢化钠的条件下与丙酸乙酯发生克莱森酯交换反应,得到溴代的2-甲基-1, 3-茚二酮(ID1,ID3)。在乙醇钠的条件下溴代的2-甲基-1, 3-茚二酮进一步拔氢上甲基,得到溴代的2, 2-二甲基-1, 3-茚二酮(ID2,ID4)。最后以醋酸钯为催化剂、三叔丁基膦为配体,溴代的2, 2-二甲基-1, 3-茚二酮分别与二甲基吖啶和吩噁嗪发生Buchwald-Hartwig偶联反应,从而得到目标分子IDYD、IDPXZ和ID2PXZ。
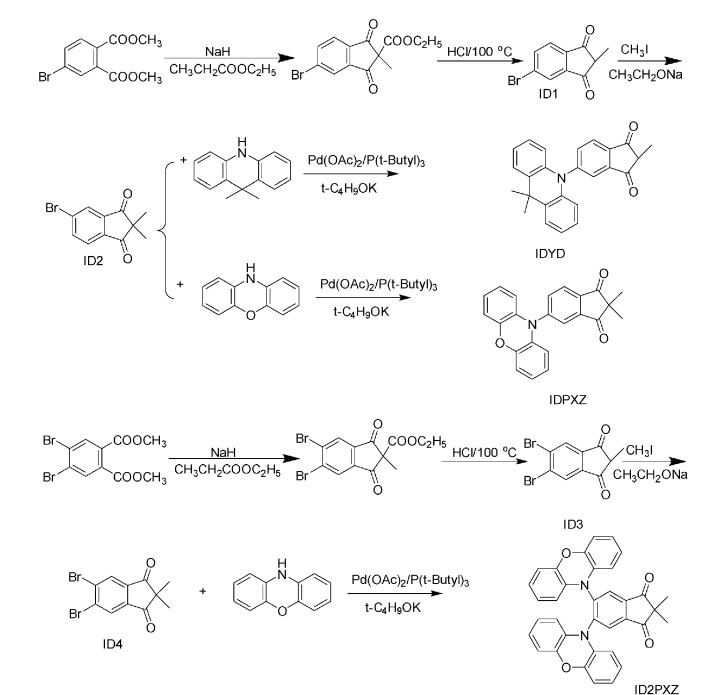
|
图 1 IDYD、IDPXZ和ID2PXZ的合成路线 Fig.1 Synthesis routes of IDYD, IDPXZ and ID2PXZ |
我们利用DFT计算研究了IDPXZ、IDYD和ID2PXZ的HOMO和LUMO分布。如图 2a和图 2b所示,IDPXZ的HOMO轨道主要分布在吩噁嗪片段及与其相连的中心苯环上,LUMO则分布在茚二酮的两个羰基及苯环上。HOMO和LUMO在中间的苯环上有一定的重叠。相比之下IDYD的吖啶环的空间位阻比吩噁嗪更大,因此IDYD的HOMO主要分布在吖啶环上,而LUMO则分布在茚二酮的两个羰基及苯环上,HOMO和LUMO仅在苯环上有极小的重叠(图 2c,图 2d)。ID2PXZ通过在羰基的对位连接上两个吩噁嗪片段,大大地增大了电子给体和电子受体之间的位阻,其HOMO被限制在吩噁嗪片段,LUMO则限制在茚二酮片段,HOMO和LUMO仅在苯环上有极小的重叠。IDPXZ、IDYD和ID2PXZ的HOMO与LUMO的较小重叠,有利于分子实现极小的ΔEST。
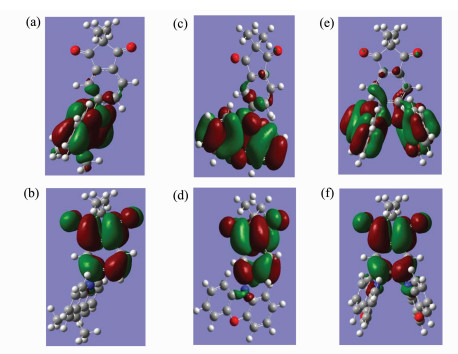
|
图 2 IDYD的HOMO(a)、LUMO(b)轨道分布;INPXZ的HOMO(c)、LUMO(d)轨道分布;ID2PXZ的HOMO(e)、LUMO(f)轨道分布 Fig.2 HOMO (a) and LUMO (b) distributions of IDYD; HOMO (c) and LUMO (d) distributions of IDPXZ; HOMO (e) and LUMO (f) distributions of ID2PXZ |
对于IDPXZ、IDYD和ID2PXZ的激发态性质,可以通过分析IDPXZ、IDYD和ID2PXZ的光物理性能得到。通过测量IDPXZ、IDYD和ID2PXZ浓度为1×10-3 mmol/L的乙酸乙酯稀溶液的室温紫外-可见(UV-Vis)吸收和荧光光谱(图 3a),可以看出IDPXZ和ID2PXZ均在360 nm到480 nm范围内表现出较强的分子内电荷转移(ICT)的吸收,在280 nm到340nm范围内表现出π-π*跃迁吸收,而IDYD在360 nm到460 nm范围内的分子内电荷转移(ICT)的吸收则较弱。从IDPXZ、IDYD和ID2PXZ的紫外吸收起始位置,可以计算出IDPXZ、IDYD和ID2PXZ的光学带隙(Eg)分别为2.38 eV、2.53 eV和2.37 eV。此外我们以硫酸奎宁溶液为参比,以360 nm为激发波长测试了IDPXZ、IDYD和ID2PXZ在甲苯溶液中的荧光量子产率(PLQY),其中IDPXZ的PLQY为30%,IDYD为35%,IDPXZ为37%。
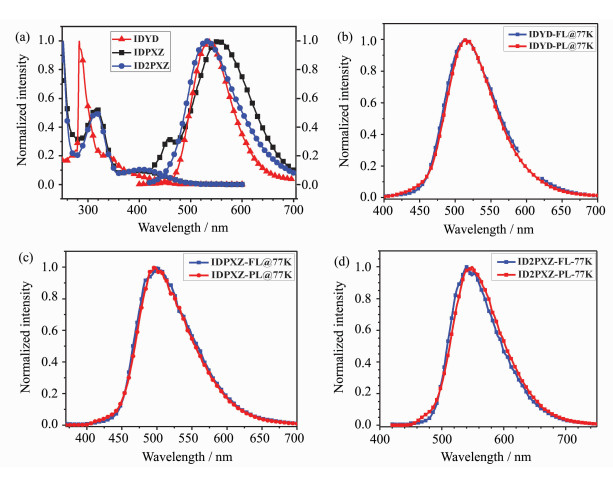
|
图 3 IDYD、IDPXZ和ID2PXZ的光物理性质图 (a) IDYD、IDPXZ及ID2PXZ在乙酸乙酯稀溶液中的UV-Vis吸收及发射光谱;(b)、(c)、(d)分别为IDYD、IDPXZ及ID2PXZ的二甲基四氢呋喃稀溶液在77 K的荧光及磷光光谱 Fig.3 Photophysical propertiesof IDYD, IDPXZ, and ID2PXZ UV-Vis absorption and fluorescence spectra in ethyl acetate of IDYD, IDPXZ and ID2PXZ (a); fluorescence and phosphorescence spectra of IDYD (b), IDPXZ (c) and ID2PXZ (d) in dilute dimethyl tetrahydrofuran under 77 K |
为了区分荧光和磷光光谱以准确地计算出IDYD、IDPXZ和ID2PXZ的S1能级和T1能级,我们以360 nm为激发波长,在77 K条件下,分别测试了浓度为1×10-3 mmol/L IDY、IDPXZ和ID2PXZ的二甲基四氢呋喃溶液的荧光和4 ms延迟之后的磷光光谱图(以规避微秒级延迟荧光寿命的影响)(图 3b~图 3d)。通过荧光峰和磷光峰的起始位置计算出IDYD的S1能级为2.70 eV,T1能级为2.69 eV;IDPXZ的S1能级为2.51 eV,T1能级为2.48 eV;ID2PXZ的S1能级为2.53 eV,T1能级为2.51 eV,因此计算可得IDYD的ΔEST为0.01 eV,IDPXZ的ΔEST为0.03 eV,ID2PXZ的ΔEST为0.02 eV。极其小的ΔEST使得IDPXZ、IDYD和ID2PXZ三重态激子可以在室温上转换为单重态激子进而跃迁发光,从而实现延迟荧光。
为了研究IDYD、IDPXZ及ID2PXZ的延迟荧光性能,我们测试了三者掺杂浓度为10%(质量分数)的mCP薄膜在空气及氩气气氛下的时间分辨光谱(图 4a~4c)。三者的时间分辨光谱皆显示出纳秒级的瞬态发光寿命和微秒级的延迟发光寿命。在氩气气氛下,IDYD的瞬态寿命为6.5 ns,延迟寿命为302.3 μs;IDPXZ的瞬态寿命为10.0 ns,延迟寿命为114.6 μs;ID2PXZ的瞬态寿命为14.1 ns,延迟寿命为118.0 μs。此外三者在空气气氛下测得的时间分辨荧光光谱,其延迟荧光组分均明显降低,这是因为氧气可以猝灭三重态激子,使其无法上转换为单重态激子而跃迁发光。该现象也进一步证明了IDYD、IDPXZ和ID2PXZ均具有延迟荧光性质。
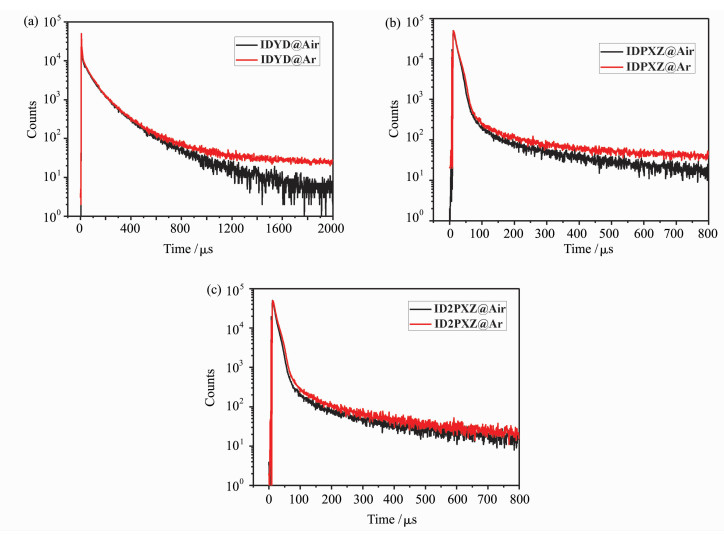
|
图 4 IDYD、IDPXZ和ID2PXZ的时间分辨光谱 测试条件:mCP为主体材料,IDYD、IDPXZ、ID2PXZ掺杂浓度为10%(质量分数), 激发波长300 nm, IDYD发光峰位置490 nm, IDPXZ发光峰位置560 nm, ID2PXZ发光峰位置550 nm Fig.4 Time-resolved spectra of IDYD, IDPXZ and ID2PXZ Test conditions: mCP as a host material, doping concentration of IDYD, IDPXZ and ID2PXZ is 10%(mass fraction) respectively, excitation wavelength is 300 nm, emission peak of IDYD is 480 nm, emission peak of IDPXZ is 560 nm, emission peak of ID2PXZ is 550 nm |
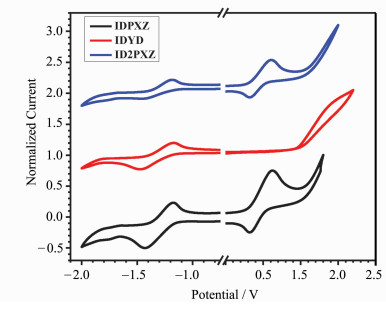
我们利用循环伏安法,以二茂铁为内标,研究了IDPXZ、IDYD和ID2PXZ的(图 5)的电化学性能。
|
图 5 IDPXZ,IDYD和ID2PXZ在乙腈溶液中的循环伏安曲线 Fig.5 Cyclic voltammograms of IDYD, IDPXZ and ID2PXZ in acetonitrile solution |
通过IDPXZ、IDYD和ID2PXZ在乙腈溶液中的循环伏安曲线的氧化峰起始位置及还原峰起始位置,我们可以算出IDPXZ的HOMO为-5.17 eV,LUMO为-3.24 eV,IDYD的HOMO能级为-5.85 eV,LUMO能级为-3.25 eV,ID2PXZ的HOMO能级为-5.17 eV,LUMO能级为-3.30 eV。相比于以苯氰为电子受体的TADF分子,以茚二酮为电子受体的TADF分子的LUMO能级有了明显的减低,这是羰基的强吸电子能力和共轭作用所导致的。更低的LUMO能级也意味着基于茚二酮的分子较苯氰类材料会发光红移。IDYD的二甲基吖啶环给电子能力较弱,因此表现出较低的HOMO能级,而吩噁嗪具有较强的给电子能力,因此IDPXZ和ID2PXZ具有较高的HOMO能级。IDYD、IDPXZ和ID2PXZ的化学物理性质总结为表 2。
| 表 2 IDYD、IDPXZ和ID2PXZ的化学物理性质总结 Table 2 Chemical and physical property summary of IDYD, IDPXZ and ID2PXZ |
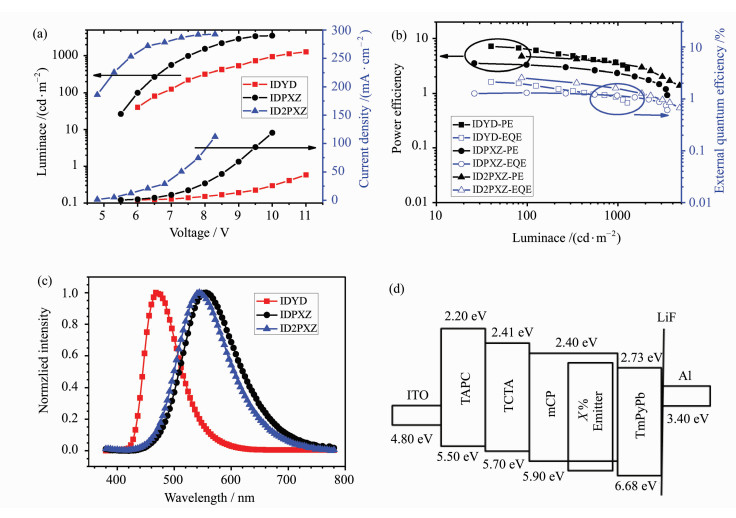
为研究IDPXZ、IDYD和ID2PXZ的电致发光(EL)的性能,我们制备并优化了结构为ITO/TAPC(40 nm)/TCTA(5 nm)/mCP:X% IDPXZ、IDYD或ID2PXZ (20 nm)/TmPyPb(35 nm)/LiF(1 nm)/Al的OLED器件。其中IDPXZ和ID2PXZ器件的最佳浓度为3%(质量分数),而IDYD器件的最佳浓度为2%。其中铟锡氧化物(ITO)和LiF/Al分别被用作阳极和阴极; TAPC作为空穴传输层;TCTA是激子阻挡层,TmPyPb为电子传输层、空穴阻挡和激子阻挡层(器件材料的结构式及名称请见表 3)。
| 表 3 OLEDs器件材料的结构式及名称表 Table 3 Structure formula and name table of materials used in OLEDs device |
IDYD、IDPXZ和ID2PXZ的电致发光性能总结为表 4。如图 6所示,基于IDYD的OLED器件,开启电压(20 cd·m-2亮度)为6.0 eV,最大电流效率(CE)为16.15 cd·A-1,最大功率效率(PE)为7.18 lm·W-1的,最大EQE为2.13%,最大亮度可达1000 cd·m-2。器件的发光峰值为470 nm,CIE值为(0.27,0.31),发光颜色为蓝光。而基于IDPXZ的OLED器件的开启电压(20 cd·m-2亮度)为5.5 eV,最大CE为5.75 cd·A-1,最大PE为3.49 lm·W-1,最大EQE为1.31%,随着亮度的增大, EQE只有小幅度下降,最大亮度可达3000 cd·m-2,这也说明IDPXZ具有优良的发光能力。其OLED器件的发光峰值为560 nm,CIE值为(0.43,0.53),发光颜色为橙黄光。而基于ID2PXZ的OLED器件的开启电压(20 cd·m-2亮度)为4.8 eV,最大电流效率为7.18 cd·A-1,最大功率效率为4.70 lm·W-1的,EQE为2.55%,只有小幅度衰减,最大亮度可达3000 cd·m-2。器件的发光峰值为550 nm,CIE值为(0.41,0.54),发光颜色为黄光。3个材料在器件中效率不够理想,一方面可以归因于由于它们的荧光发光效率不高; 另一方面也是因为材料的延迟寿命较长,导致了3个材料在器件中三重态激子反系间窜越效率较低,最终降低了器件中的激子利用率。上述问题有望通过进一步分子设计改进得到解决。
| 表 4 IDYD、ID2PXZ及IDPXZ的电致发光性质总结 Table 4 Summary of EL properties of IDYD、IDPXZ and ID2PXZ |
|
图 6 IDYD、IDPXZ和ID2PXZ的电致发光性能 (a) IDYD、IDPXZ和ID2PXZ的OLEDs器件电压-电流密度-亮度曲线;(b) IDYD、IDPXZ和ID2PXZ的OLED器件亮度-功率效率-外量子效率曲线;(c) IDYD、IDPXZ和ID2PXZ的电致发光光谱;(d) IDYD、IDPXZ和ID2PXZ的OLED器件结构图 Fig.6 Electroluminescence properties of IDYD, IDPXZ and ID2PXZ (a) Voltage-current density-luminance curve of OLEDs; (b) luminance-power efficiency-external quantum efficiency curve of OLEDs; (c) electroluminescence spectra; (d)structure of OLEDs |
在本文中,我们设计合成了新型的具有强吸电子能力的电子受体结构2, 2-二甲基-1, 3-茚二酮,并首次将其应用于TADF分子设计中。其中以2, 2-二甲基-1, 3-茚二酮为电子受体,二苯胺衍生物为电子给体的分子IDYD、IDPXZ和ID2PXZ均具有较小的HOMO/LUMO重叠和极小的ΔEST,具有理想的TADF性质和优良的发光性质。
以IDYD为客体掺杂可以得到蓝光OLED器件,其CIE值为(0.27,0.31),最大EQE为2.13%;以IDPXZ为客体掺杂可以得到橙光OLED器件,其CIE值为(0.43,0.53),最大EQE为1.31%;以ID2PXZ为客体掺杂可以得到黄光OLED器件,其CIE值为(0.41,0.54),最大EQE为2.55%。这也证明了以2, 2-二甲基-1, 3-茚二酮为电子受体的TADF分子在不同颜色的OLED器件中的应用及前景。
致谢 感谢国家重点研发计划项目(2016YFB0401002)、国家自然科学基金项目(51533005)、优势学科和青蓝工程项目资助!| [1] | Tang C W, vanSlyke S A. Organic electroluminescent diodes[J]. Applied Physics Letters, 1987, 51(12): 913–915. DOI:10.1063/1.98799 |
| [2] | Gong X, Robinson M R, Ostrowski J C, Moses D G, Bazan C, Heeger A J. High-efficiency polymer-based electrophos-phorescent devices[J]. Advanced Materials, 2002, 14(8): 581–585. DOI:10.1002/1521-4095(20020418)14:8<>1.0.CO;2-F |
| [3] | Zheng C J, Wang J, Ye J, LoM F, Liu X K, Fung M K, Zhang X H, Lee C S. Novel efficient blue fluorophors with small singlet-triplet splitting:hosts for highly efficient fluorescence and phosphorescence hybrid WOLEDs with simplified structure[J]. Advanced Materials, 2013, 25(15): 2205–2211. DOI:10.1002/adma.201204724 |
| [4] | Liu X K, Zheng C J, Lo M F, Xiao J, Chen Z, Liu C L, Zhang X H. Novel blue fluorophor with high triplet energy level for high performance single-emitting-layer fluorescence and phosphorescence hybrid white organic light-emitting diodes[J]. Chemistry of Materials, 2013, 25(21): 4454–4459. DOI:10.1021/cm403318r |
| [5] | Wang Q, Oswald I W, Perez M R, Jia H, Shahub A A, Qiao Q, Gnade B E, Omary M A. Doping-free organic light-emitting diodes with very high power efficiency, simple device structure, and superior spectral performance[J]. Advanced Functional Materials, 2014, 24(30): 4746–4752. DOI:10.1002/adfm.v24.30 |
| [6] | Rajamalli P, Senthilkumar N, Gandeepan P, Huang P Y, Huang M J, Ren-Wu C Z, Yang C Y, Chiu M J, Chu L K, Lin H W, Cheng C H. A new molecular design based on thermally activated delayed fluorescence for highly efficient organic light emitting diodes[J]. Journal of the American Chemical Society, 2016, 138(2): 628–634. DOI:10.1021/jacs.5b10950 |
| [7] | Tao Y, Yuan K, Chen T, Xu P, Li H, Chen R, Zheng C, Zhang L, Huang W. Thermally activated delayed fluorescence materials towards the breakthrough of organoelectro-nics[J]. Advanced Materials, 2014, 26(47): 7931–7958. DOI:10.1002/adma.v26.47 |
| [8] | Yuan X D, Liang J, He Y C, Li Q, Zhong C, Jiang Z Q, Liao L S. A rational design of carbazole-based host materials with suitable spacer group towards highly-efficient blue phosphorescence[J]. Journal of Materials Chemistry C, 2014, 2(31): 6387–6394. DOI:10.1039/C4TC00867G |
| [9] | Kim K H, Moon C K, Lee J H, Kim S Y, Kim J J. Highly efficient organic light-emitting diodes with phosphorescent emitters having high quantum yield and horizontal orientation of transition dipole moments[J]. Advanced Materials, 2014, 26(23): 3844–3847. DOI:10.1002/adma.201305733 |
| [10] | Su SJ, Cai C, Kido J. RGB phosphorescent organic light-emitting diodes by using host materials with heterocyclic cores:effect of nitrogen atom orientations[J]. Chemistry of Materials, 2010, 23(2): 274–284. |
| [11] | Uoyama H, Goushi K, Shizu K, Nomura H, Adachi C. Highly efficient organic light-emitting diodes from delayed fluorescence[J]. Nature, 2012, 492(7428): 234–238. DOI:10.1038/nature11687 |
| [12] | Goushi K, Yoshida K, Sato K, Adachi C. Organic light-emitting diodes employing efficient reverse intersystem crossing for triplet-to-singlet state conversion[J]. Nature Photonics, 2012, 6(4): 253–258. DOI:10.1038/nphoton.2012.31 |
| [13] | Liu W, Zheng C J, Wang K, Chen Z, Chen D Y, Li F, Ou X M, Dong Y P, Zhang X H. Novel carbazol-pyridine-carbonitrile derivative as excellent blue thermally activated delayed fluorescence emitter for highly efficient organic light-emitting devices[J]. ACS Applied Materials & Interfaces, 2015, 7(34): 18930–18936. |
| [14] | Liu X K, Chen Z, Zheng C J, Liu C L, Lee C S, Li F, Ou X M, Zhang X H. Prediction and design of efficient exciplex emitters for high-efficiency, thermally activated delayed-fluorescence organic light-emitting diodes[J]. Advanced Materials, 2015, 27(14): 2378–2383. DOI:10.1002/adma.v27.14 |
| [15] | Suzuki K, Kubo S, Shizu K, Fukushima T, Wakamiya A, Murata Y, Adachi C, Kaji H. Triarylboron-based fluorescent organic light-emitting diodes with external quantum efficiencies exceeding 20%[J]. Angewandte Chemie, 2015, 127(50): 15446–15450. DOI:10.1002/ange.201508270 |
| [16] | Hirata S, Sakai Y, Masui K, Tanaka H, Lee S Y, Nomura H, Nakamura N, Yasumatsu M, Nakanotani H, Zhang Q, Shizu K. Highly efficient blue electroluminescence based on thermally activated delayed fluorescence[J]. Nature Materials, 2015, 14(3): 330–336. |
| [17] | Tanaka H, Shizu K, Miyazaki H, Adachi C. Efficient green thermally activated delayed fluorescence (TADF) from a phenoxazine-triphenyltriazine (PXZ-TRZ) derivative[J]. Chemical Communications, 2012, 48(93): 11392–11394. DOI:10.1039/c2cc36237f |
| [18] | Li J, Nakagawa T, MacDonald J, Zhang Q, Nomura H, Miyazaki H, Adachi C. Highly efficient organic light-emitting diode based on a hidden thermally activated delayed fluorescence channel in a heptazine derivative[J]. Advanced Materials, 2013, 25(24): 3319–3323. DOI:10.1002/adma.v25.24 |
| [19] | Chen D Y, Liu W, Zheng C J, Wang K, Li F, Tao S L, Ou X M, Zhang X H. Isomeric thermally activated delayed fluorescence emitters for color purity-improved emission in organic light-emitting devices[J]. ACS Applied Materials & Interfaces, 2016, 8(26): 16791–16798. |
| [20] | Etherington M K, Franchello F, Gibson J, Northey T, Santos J, Ward J S, Higginbotham H F, Data P, Kurowska A, Dos Santos P L, Graves D R. Regio-and conformational isomerization critical to design of efficient thermally-activated delayed fluorescence emitters[J]. Nature Communications, 2017, 8: 14987. DOI:10.1038/ncomms14987 |
| [21] | Wong M Y, Hedley G J, Xie G, Kölln L S, Samuel I D, Pertegás A, Bolink H J, Zysman-Colman E. Light-emitting electrochemical cells and solution-processed organic light-emitting diodes using small molecule organic thermally activated delayed fluorescence emitters[J]. Chemistry of Materials, 2015, 27(19): 6535–6542. DOI:10.1021/acs.chemmater.5b03245 |
| [22] | Zhu G X, Zhang X M. Additive effects in Ir-BICP catalyzed asymmetric hydrogenation of imines[J]. Tetrahedron:Asymmetry, 1998, 9(14): 2415–2418. DOI:10.1016/S0957-4166(98)00232-8 |
| [23] | Shibayama N, Inoue Y, Abe M, Kajiyama S, Ozawa H, Miura H, Arakawa H. Novel near-infrared carboxylated 1, 3-indandione sensitizers for highly efficient flexible dye-sensitized solar cells[J]. Chemical Communications, 2015, 51(64): 12795–12798. DOI:10.1039/C5CC03049H |
| [24] | Utinans M, Neilands O. Quantum chemical calculations, synthesis and properties of novel organic molecules with photoinduced intramolecular electron transfer and large change in electric dipole moment in the excited state[J]. Advanced Functional Materials, 1999, 9(1): 19–25. |
| [25] | Kirchwehm Y, Damme A, Kupfer T, Braunschweig H, Krueger A. Ortho-methylated tribenzotriquinacenes-paving the way to curved carbon networks[J]. Chemical Communications, 2012, 48(10): 1502–1504. DOI:10.1039/C1CC14703J |
| [26] | Singh A, Lim C K, Lee Y D, Maeng J H, Lee S, Koh J, Kim S. Tuning solid-state fluorescence to the near-infrared:a combinatorial approach to discovering molecular na-noprobes for biomedical imaging[J]. ACS Applied Mate-rials & Interfaces, 2013, 5(18): 8881–8888. |