2. 大连大学 辽宁省生物有机化学重点实验室, 辽宁 大连 116622;
3. 大连大学 环境与化学工程学院, 辽宁 大连 116622
2. Liaoning Key Laboratory of Bio-organic Chemistry, Dalian University, Dalian 116622, Liaoning, P. R. China;
3. School of Environmental and Chemical Engineering, Dalian University, Dalian 116622, Liaoning, P. R. China
肌红蛋白(myglobin,Mb)作为过氧化氢模拟酶,在生物检测中比天然酶有很多潜在的优势[1],工程学手段和化学修饰方法已被大量地用于对Mb的改造,以使其具有新的结合位点和酶学性质[2,3]。例如,Watanabe小组[4-6]研究发现,将Mb末端组氨酸突变后,其催化活性和H2O2活化过程都有很大改变。唐乾等[7]利用圆二色谱技术改变Mb表面44位氨基酸,即将Asp突变为Lys后,增强了肌红蛋白耐热变性能力和耐酸性的能力,导致Mb的热变性中点温度Tm由77.5 ℃增加到85 ℃,变性中点pH由4.75降到4.00。很多研究者也发现,在表面氨基酸改变后,野生型肌红蛋白在表面活性、与氧化剂及氧结合能力方面均出现很大的变化[8-10]。
荧光法作为一类可以揭示溶液中蛋白质结构和功能的技术方法[11],已被广泛应用于医学、化学、考古学、生物学和环境科学等领域。荧光法需样品量少、灵敏度高、选择性好,可作为药物与生物大分子作用的主要研究手段。荧光光谱测定能够给出诸多参数值,研究者既能了解成键情况,也能通过定量分析来推断蛋白质的构象变化。Mb由于含有色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)3种芳香族氨基酸而具有内源性荧光,其中色氨酸有2个,所以其内源荧光强度比较高,因此荧光光谱法可作为一种有效的手段研究其构象的变化。
特定位点氨基酸的改变对蛋白荧光产率的影响很少有报道。为了解Mb60位Asp突变为Lys后荧光强度的改变及不同外界因素对荧光强度的影响,本课题组以野生型肌红蛋白基因为模板[12],通过PCR定点突变技术方法将马心肌红蛋白表面60位天冬氨酸Asp(D)突变为赖氨酸Lys(K),经42 ℃热激转化到表达载体大肠杆菌BL21中,然后通过微生物大量培养,进行高效表达。然后将细胞破碎得到表达产物,再用特定的纯化方法进行分离纯化,获得纯的突变体(D60K Mb)用于实验研究。在实验中我们发现,相同条件下,当紫外-可见吸收光谱基本一致的情况下,(D60K)的荧光强度要远大于Mb。
1 实验部分 1.1 试剂与仪器试剂:野生型马心肌红蛋白Mb,购自Sigma公司,使用前未经进一步提纯,使用时配置成1.5×10-5 mol·L-1的储备液;肌红蛋白突变体(D60K Mb)通过培养含有(D60K Mb)基因的大肠杆菌(由大连理工大学生物化工学院王静云教授惠赠)获得,实验前稀释为1.5×10-5 mol·L-1的储备液;Trp、Lys、Asp(电泳纯),使用前配置成3×10-3 mol·L-1的储备液,缓冲溶液为0.05 mol·L-1的Na2HPO4/NaH2PO4(pH=6.0,pH=7.40,pH=8.0),Na2HPO4·12H2O和NaH2PO4·2H2O都是分析纯。以上试剂均置于冰箱中(4 ℃)保存;实验用水为超纯水。
仪器:V-560型UV-Vis光谱仪(日本,Jasco),FP-6500型荧光/磷光光谱仪(日本,Jasco),F-12型制冷和加热循环器(德国,Julabo公司),实验室用pH计(PHSJ-4A,上海雷磁分析仪器厂)。
1.2 实验方法 1.2.1 紫外-可见吸收光谱取2 mL Mb溶液加入比色池中,记录Mb在280 nm处的吸光度。D60K Mb和Trp在280 nm处的吸光度测定步骤同上。
1.2.2 荧光发射光谱和同步荧光光谱在比色池中加入2 mL Mb溶液,以280 nm为激发波长,带宽为5 nm×5 nm,扫描速度为500 nm·min-1,在FP-6500型荧光分光光度计上记录290~400 nm波长范围的荧光光谱。D60K Mb的荧光光谱测定步骤同上。再以同样的方法检测激发波长为280 nm处不同氨基酸溶液的荧光发射光谱。同步荧光光谱的测定条件同上。
1.2.3 圆二色光谱移取600 μL Mb溶液于0.1 cm石英比色池中,记录Mb中加入三氟乙醇(TFE)前后圆二色谱图的变化。狭缝宽度1 nm,扫描波长范围为190~240 nm,扫描速度为100 nm·min-1,累计3次。D60K Mb的圆二色谱测定步骤同上。
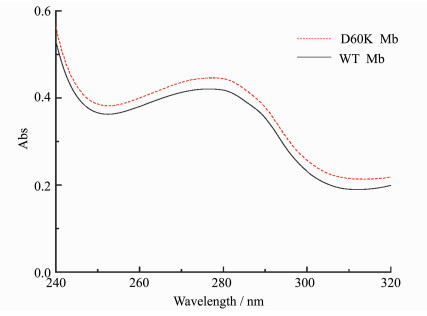
2 结果与讨论 2.1 WT Mb和D60K Mb的紫外-可见吸收光谱比较图 1是WT Mb和D60K Mb的紫外-可见吸收光谱,由图可知,在浓度、pH、温度均一致的条件下,WT Mb和D60K Mb在280 nm处的吸收大致相同,说明紫外-可见吸收光谱不能反映WT Mb和D60K Mb的差别。
|
图 1 WT Mb与D60K Mb的紫外-可见吸收光谱 Fig.1 UV-Vis absorption spectra of WT Mb and D60K Mb |
荧光量子产率为物质的发射荧光量子数与吸收量子数之比,一般用相对法测量。通过测量待测物质与参比物质的稀溶液在同一激发波长下的积分荧光强度和对该波长激发光的吸光度,按式(1) 计算待测物质的荧光量子产率:
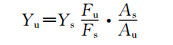
|
(1) |
式中,Yu和Ys分别代表待测物质和参比物质的荧光量子产率,Fu和Fs分别代表待测物质和参比物质的积分荧光强度,Au和As分别代表待测物质和参比物质对该激发光的吸光值。通过式(1) 可以测量荧光量子产率,并且不要求已知被测荧光物质的准确浓度值。本实验在PB缓冲溶液中进行,温度为室温条件(25 ℃),pH=7.4,以L-Trp溶液在激发波长280 nm时的荧光量子产率为参比,测量所得的结果如表 1所示。
| 表 1 Trp、WT Mb和D60K Mb的荧光量子产率(室温) Table 1 Fluorescence quantum yields of Trp、WT Mb and D60K Mb |
通过式(1) 计算可以得知YD60K Mb /YTrp=0.23089,YWT Mb/YTrp=0.03178,说明D60K Mb的荧光量子产率要远大于WT Mb(0.23089/0.03178=7.3倍)。
为寻找产生这一现象的原因,我们通过以下实验进一步研究。
2.3 造成肌红蛋白荧光强度发生变化的相关因素 2.3.1 游离氨基酸与WT Mb及D60K Mb荧光强度的比较由图 2 A可知,当以280 nm为激发波长时,WT Mb的最大发射波长出现在325 nm处,荧光强度为8,D60K Mb的最大发射波长出现在330 nm处(第60位氨基酸的改变,使得D60K Mb的极性增大,π-π*跃迁谱带发生红移[15]),荧光强度接近80。当以280 nm为激发波长时,Mb的荧光光谱主要由Trp贡献,在本实验中D60K Mb将60位Asp突变为Lys,因此我们又研究了相同条件下游离Trp、Trp和Asp的混合溶液、Trp和Lys的混合溶液的荧光发射光谱强度。研究发现:在游离Trp中分别加入相同浓度的Asp和Lys后,由于氨基酸所带电荷不同,Trp和Lys的混合溶液的荧光强度要高于Trp和Asp混合溶液的荧光强度,说明Mb表面60位氨基酸由Asp突变为Lys后,对其荧光强度有一定的影响。
同步荧光光谱具有光谱简化、谱带窄化、光谱重叠减小和散射光减小等其他光谱不具备的优点,因此已经成为用于判断蛋白质构象变化的重要手段之一[16]。当波长差Δλ=20 nm时,同步荧光光谱仅显示Tyr残基的荧光特性;当Δλ=60 nm时,同步荧光光谱仅显示Trp残基的荧光特性[17]。考察了Δλ分别为20 nm、60 nm时WT Mb和D60K Mb的同步荧光光谱, 结果如图 2C、2D所示,当Δλ=20 nm时荧光光谱为蛋白Tyr残基的特征,WT Mb在311 nm处的荧光强度为100,D60K Mb在311 nm处的荧光强度为479.6;当λ=60 nm时荧光光谱为蛋白Trp的特征,WT Mb在341 nm处的最大荧光强度为144.2,D60K Mb在341 nm处的最大荧光强度为960.5。由以上数据可知:以280 nm为激发波长时的发射光谱的荧光强度F(D60K Mb)/F(WT Mb)=80/8=10;当Δλ=20 nm时,F(D60K Mb)/F(WT Mb)=479/100=4.79;当Δλ=60 nm时,F(D60K Mb)/F(WT Mb)=960/144=6.67。

|
图 2 WT Mb、D60K Mb的荧光发射光谱(A)、同步荧光光谱(C, D)和不同游离氨基酸的荧光发射光谱(B) A.测定灵敏度:低;B.测定灵敏度:低;C. Δλ=20 nm,测定灵敏度:中;D.Δλ=60 nm,测定灵敏度:中 Fig.2 Emission spectra (A) and synchronous spectra(C, D) of WT Mb, D60K Mb and the emission spectrum of different free amino acids(B) A. sensitivity: low; B. the arrow indicate the direction of the emission spectra of tryphophan, tryphophan and asparagine, tryphophan and lysine, sensitivity: low; C. Δλ=20 nm, sensitivity: medium; D. Δλ=60 nm, sensitivity: medium |
WT Mb和D60K Mb都为肌红蛋白,在溶液浓度、酸碱度等条件都相同的情况下,D60K Mb只是60位Asp突变为Lys,根据公式[11]:
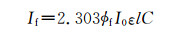
|
(2) |
式中, If代表荧光强度;φf代表荧光量子产率;I0为入射光强度。由式(2) 可知荧光强度和φf、I0、ε、l和C有关,εlC=A,由紫外光谱数据可知WT Mb和D60K Mb的A值大致相同,而I0固定不变,所以只和φf有关。激发态分子的去激发过程包括无辐射跃迁过程和辐射跃迁过程,发生辐射跃迁即产生荧光:
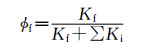
|
(3) |
Kf表示辐射跃迁的速率常数,主要取决于分子的化学结构,符号Ki代表着无辐射跃迁时的速率常数,这一值大小主要取决于化学环境的变化,同时也与化学结构有一定的关系。由式(3) 可以看出,不同的跃迁类型间的竞争程度会影响φf,说明60位氨基酸由Asp突变为Lys后,处于激发态的分子去激发过程主要以辐射跃迁为主,而野生型的Mb分子去激发过程主要以无辐射跃迁为主。
2.3.2 pH值对肌红蛋白荧光强度的影响我们分别考察了不同pH值条件下,WT Mb和D60K Mb的荧光光谱(图 3A)和同步荧光光谱(图 3,B:Δλ=20 nm,C:Δλ=60 nm)。WT Mb和D60K Mb的荧光光谱和同步荧光光谱强度均受pH影响较大。WT Mb的荧光光谱和同步荧光光谱的荧光强度有如下特征:FpH=6 < FpH=8 < FpH=7.4,而对于D60K Mb,随着pH的增大,其荧光光谱和同步荧光光谱的荧光强度变化较小且呈增加趋势。经分析,WT Mb的等电点是6.99,pH=6时,蛋白溶液处于偏酸性条件下,蛋白带有正电荷,当pH=7.4时,蛋白溶液呈近中性,当pH=8时,蛋白溶液呈弱碱性,蛋白带负电荷,说明蛋白所带电荷的性质对蛋白荧光强度的影响较大。D60K Mb的表面60位Asp突变为Lys,使蛋白表面电荷由负电荷多变成正电荷多,等电点降低,因而当溶液pH=7.4时,蛋白溶液呈弱碱性,比野生型Mb电离多,因此pH=7.4时蛋白的荧光强度发生明显的改变。从实验结果可知,WT Mb在生理pH值附近,接近7.4时蛋白质电离最少,荧光强度最大,而其它情况有电离时,不论蛋白带正电荷还是负电荷,荧光强度都较低。但是具体的原因尚不清楚。
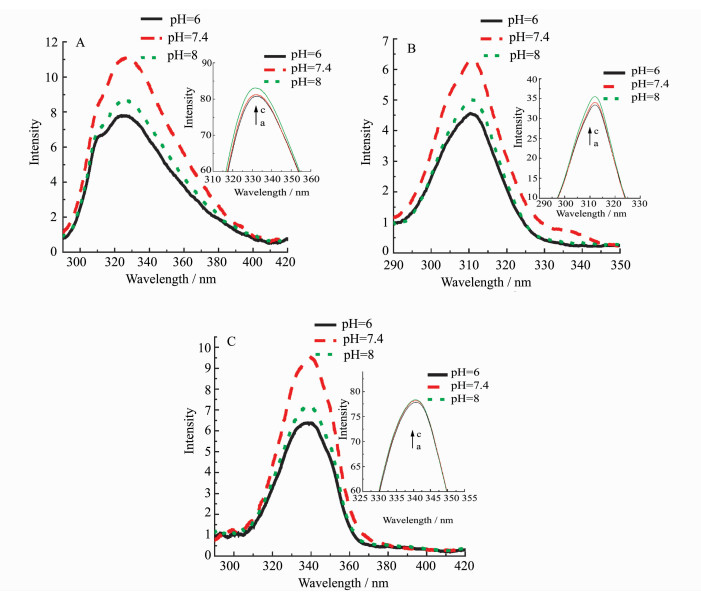
|
图 3 pH对WT Mb和D60K Mb (右上角)的荧光光谱(A)和同步荧光光谱(B,C)的影响 Fig.3 Fluorescence spectra(A) and syochronous spectra(B, C) of WT Mb and D60K Mb (top right corner) with the effect of pH B:Δλ=20 nm, C:Δλ=60 nm; a:pH=6.0, b: pH=7.4, c: pH=8 |
图 4A为相同条件下WT Mb和D60K Mb的圆二色谱图,由图可知,相同条件下,WT Mb和D60K Mb的二级结构存在较明显的差别,通过CD光谱仪自带二级结构分析软件[18],可以计算出蛋白中α-螺旋、β-折叠、无规则卷曲的含量。WT Mb的α-螺旋含量为65.5%,D60K Mb的α-螺旋含量为57.1%。在D60K Mb溶液中逐次加入等量的三氟乙醇(表 2),促使其α-螺旋的生成,随着三氟乙醇含量的增加,D60K Mb的α-螺旋含量逐渐增加,此时,其荧光光谱和同步荧光光谱的荧光强度均逐渐降低,说明二级结构对蛋白的荧光量子产率有一定的影响。
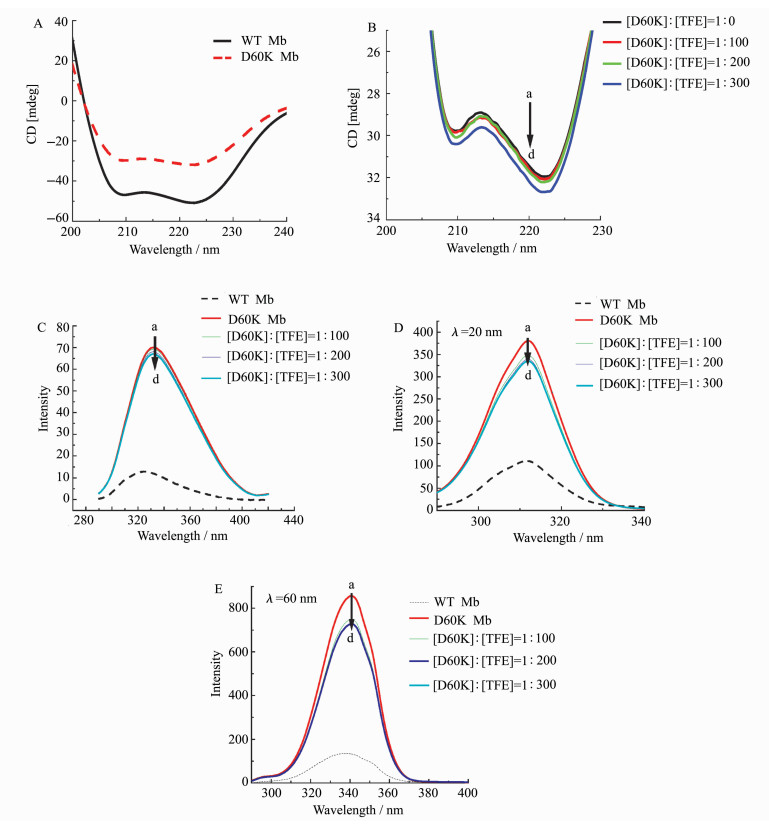
|
图 4 相同条件下WT Mb、D60K Mb的圆二色谱图(A)和不同浓度的三氟乙醇对D60K Mb的圆二色谱(B)、荧光光谱(C,响应灵敏度:低)、同步荧光光谱(D, E, 响应灵敏度:中)的影响 Fig.4 CD spectra of WT Mb and D60K Mb (A) and the change of CD spectra (B), fluorescence spectra(C, sensitivity: low), syochronous spectra(D, E, sensitivity: medium) of D60K Mb with the addtion of trifluoroethanol in different concentration a-d: [(D60K Mb)]:[TFE]=1:0, 1:100, 1:200, 1:300(in B, C, D, E) |
| 表 2 添加不同比例三氟乙醇的D60K Mb的二级结构变化 Table 2 Secondary structure changes of D60K Mb with trifluoroethanol in different ratio |
通过本实验,我们认为当肌红蛋白(Mb)60位Asp变为Lys后,不仅改变了蛋白的表面电荷,对蛋白的二级结构也有一定的影响,使处于激发态的分子的去激发过程由原来的无辐射能量转移变为辐射能量转移,同时,蛋白生色基团由原来的包裹状态变为较暴露状态,蛋白极性增强,荧光强度增加;由于结构和电荷的双重影响,使D60K Mb的荧光量子产率明显增强。Mb作为一种天然模拟蛋白质,在生物检测中比天然酶有很多潜在的优势,通过特殊位点氨基酸的改变增强Mb自身的荧光量子产率,将使Mb在生物检测中得到更广泛的应用。
| [1] |
郑琦, 曾元鹗, 蔡汝秀. 天然蛋白质的模拟酶特性研究及应用[J]. 分析科学学报, 2005, 21(5): 563–568.
Zheng Q, Zeng Y E, Cai R X. The study on the natural protein as simulator of peroxidase oxidase and its analytical application[J]. Journal of Analytical Science, 2005, 21(5): 563–568. |
| [2] | Ozaki S, Roach M P, Matsui T, Watanabe Y. Investigation of the roles of the distal heme environment and the proximal heme iron ligand in peroxide activation by heme enzymes via molecular engineering of myoglobin[J]. Accounts of Chemical Research, 2001, 34: 818–825. DOI:10.1021/ar9502590 |
| [3] | Hayashi T, Hisaeda Y. New functionalization of myoglobin by chemical modification of heme-propionates[J]. Accounts of Chemical Research, 2002, 35: 35–43. DOI:10.1021/ar000087t |
| [4] | Qzaki S, Matsui T, Watanabe Y. Conversion of myoglobin into a highly stereo-specific peroxygenase by the L29H/H64L mutation[J]. Journal of the A merican Chemical Socity, 1996, 118: 9784–9785. DOI:10.1021/ja961223l |
| [5] | Ozaki S, Matsui T, Watanabe Y. Conversion of myoglobin into a perxygenase:a catalytic intermediate of sulfoxidation and epoxidation by F43H/H64L mutant[J]. Journal of the A merican Chemical Socity, 1997, 119: 6666–6667. DOI:10.1021/ja970453c |
| [6] | Matsui T, Ozaki S, Liong E, Phillips G N, Watanabe Y. Effects of the location of distal histidine in the reaction of myoglobin with hydrogen peroxide[J]. Biological Chemistry, 1999, 274: 2838–2844. DOI:10.1074/jbc.274.5.2838 |
| [7] |
唐乾, 曹洪玉, 王静云, 郑学仿. 紫外吸收光谱法研究Asp44在稳定肌红蛋白结构中的作用[J]. 化学通报, 2012, 75(1): 84–87.
Tang Q, Cao H Y, Wang J Y, Zheng X F. Probe of the effect of Asp44 on the stability of myoglobin by UV-Vis spectrophotometry[J]. Chemistry Bulletin, 2012, 75(1): 84–87. |
| [8] |
职秋艳, 唐乾, 曹洪玉, 安良梅, 张莹莹, 郑学仿. 光谱法对照研究肌红蛋白及其突变体Mb(D60K)与H2O2的相互作用[J]. 光谱学与光谱分析, 2011, 31(9): 2512–2516.
Zhi Q Y, Tang Q, Cao H Y, An L M, Zhang Y Y, Zheng X F. Comparison between myoglobin and its mutant(D60K) interacting with hydrogen peroxide by spectrum[J]. Spectroscopy and Spectral Analysis, 2011, 31(9): 2512–2516. |
| [9] |
李宜雯, 曹洪玉, 唐乾, 郑学仿. 光谱与停流荧光法研究肌红蛋白及其突变体D60K与表面活性剂的相互作用[J]. 物理化学学报, 2010, 26(6): 1687–1692.
Li Y W, Cao H Y, Tang Q, Zheng X F. Spectroscopy and stopped-flow/fluorescence studies on the interactions of myoglobin and its mutant (D60K) with surfactants[J]. Acta Physico-Chimica Sinica, 2010, 26(6): 1687–1692. |
| [10] |
马君燕, 马静, 郑学仿, 唐乾, 高大彬. 荧光法对光诱导野生型肌红蛋白和突变体D44K去氧的对照研究[J]. 分析化学, 2008, 36(4): 435–439.
Ma J Y, Ma J, Zheng X F, Tang Q, Gao D B. Spectroscopic investigation of the photo-induced deoxygenization of myoglobin and It's mutant Mb(D44K)[J]. Chinese Journal of Analytical Chemistry, 2008, 36(4): 435–439. |
| [11] | Havel H A. Overview of protein structure and spectrosco-pic methods[J]. New York:VCH, 1996. |
| [12] | Hoffman B M, Celis L M, Cull D A, Patel A D, Seifert J L, Wheeler K E, Wang J Y, Yao J, Kurnikow L V, Nocek J M. Differential influence of dynamic processes on forward and reverse eletron transfer across a protein-protein interface[J]. Proceedings of the National Academy of Sciences, 2005, 102: 3564–3569. DOI:10.1073/pnas.0408767102 |
| [13] |
沙秋月, 袁雪梅, 王小雨, 陈继超, 徐莉, 徐海军. Meso位单取代卟啉及其配合物的合成、表征和光谱性质[J]. 无机化学学报, 2016, 32: 1293–1302.
Sha Q Y, Yuan X M, Wang X Y, Chen J C, Xu L, Xu H J. Syntheses, characterizations, spectroscopic properties of meso-mono-substituted porphyrins and their metal complexes[J]. Chinese Journal of Inorganic Chemistry, 2016, 32: 1293–1302. DOI:10.11862/CJIC.2016.166 |
| [14] |
谢宪, 于梅花, 张惠萍, 王益林. 抗坏血酸还原亚碲酸钠水相合成CdTe量子点[J]. 高等学校化学学报, 2015, 36(4): 608–613.
Xie X, Yu M H, Zhang H P, Wang Y L. Aqueous synthesis of CdTe quantum dots via ascorbic acid reducing sodium tellurite[J]. Chemical Journal of Chinese Universities, 2015, 36(4): 608–613. |
| [15] |
高俊杰, 余萍, 刘志江.
仪器分析[M]. 北京: 国防工业出版社, 2005.
Gao J J, Yu P, Liu Z J. Optical Analysis[M]. Beijing: National Defence Industry Press, 2005. |
| [16] |
陈国珍, 黄贤智, 郑朱梓, 许金钩, 王尊本.
荧光分析法[M]. 北京: 科学出版社, 1990.
Chen G Z, Huang X Z, Zheng Z Z, Xu J G, Wang Z B. Fluorescence Analysis[M]. Beijing: Science Press, 1990. |
| [17] | Trynda-Lemiesz L, Karaczyn A, Keppler B K. Studies on the interactions between human serum albumin and trans-indazolium(bisindazole) tetrachlororuthenate(Ⅲ)[J]. Journal Inorganic Biochemistry, 2000, 78: 341–346. DOI:10.1016/S0162-0134(00)00062-3 |
| [18] | Sreerama N, Woody R W. On the analysis of membrane protein circular dichroism spectra[J]. Protein Science, 2004, 113: 100–112. |




